阿尔茨海默病(Alzheimer’s disease, AD)不仅表现为记忆功能的丧失,而且表现为睡眠生理功能显著恶化,这在轻度认知障碍(mild cognitive impairment, MCI)阶段就已经很明显。睡眠时皮层慢振荡(slow oscillations, SO;0.5-1 Hz)和丘脑皮层纺锤体活动(12-15 Hz)以及它们的时间协调性被认为是记忆形成的关键。我们研究了慢振荡经颅直流电刺激(slow oscillatory transcranial direct current stimulation, so-tDCS)的潜力,该刺激以睡眠状态依赖的方式在白天小睡期间应用,以调节9名男性和7名女性MCI患者的这些活动模式和与睡眠相关的记忆巩固。刺激显著增加了总SO(慢振荡)和纺锤功率,在SO上升阶段放大了纺锤功率,并导致EEG记录中SO和纺锤功率波动之间更强的同步性。此外,与假刺激相比,so-tDCS改善了视觉陈述性记忆,并且视觉陈述性记忆与更强的同步性相关。这些发现为MCI患者的睡眠生理障碍和记忆缺陷提供了一种耐受性良好的治疗方法,并促进了我们对离线记忆巩固的理解。本文发表在The Journal of Neuroscience杂志。(可添加微信号siyingyxf或18983979082获取原文,另思影提供免费文献下载服务,如需要也可添加此微信号入群,原文也会在群里发布)。
温故而知新,建议结合以下相关解读阅读(直接点击,即可浏览,加微信号siyingyxf或18983979082获取原文及补充材料):
通过脑振荡的夹带调节人类记忆
多疗程40Hz tACS对阿尔茨海默病患者海马灌注的影响
通过脑电图/脑磁图观察到的大脑活动来指导经颅脑刺激
TMS-EEG的临床应用及展望
阿尔茨海默病的神经振荡和脑刺激
基于信息的无创经颅脑刺激方法
大脑区域间耦合的增加和减少会相应增加和减少人类大脑中的振荡活动
交叉频率耦合在认知控制不同成分中的因果作用
睡眠、无创脑刺激和老化的大脑研究
Nature Medicine:经颅交流电刺激可以改善强迫症
经颅电刺激对生理和病理衰老过程中情景记忆的影响
整合TMS、EEG和MRI——研究大脑连接性
使用刺激设备在神经回路调控层面对精神疾病进行治疗
θ和α振荡在工作记忆控制中作用的因果证据
TMS-EEG研究:大脑反应为卒中后的运动恢复提供个体化数据
皮质运动兴奋性不受中央区mu节律相位的调节
TMS–EEG联合分析在人类大脑皮层连接组探索中的贡献
实时EEG触发的TMS对抑郁症患者左背外侧前额叶皮层进行脑振荡同步刺激
经颅交流电刺激(tACS)有助于老年人工作记忆的恢复
tACS结合EEG研究:创造力的神经机制
经颅交流电刺激(tACS):使大脑节律同步以提高认知能力
1. 引言
在阿尔茨海默病(Alzheimer’s disease, AD)早期,形成和恢复情景记忆出现困难,并且构成了该疾病的核心组成部分。同样,睡眠障碍似乎是AD相关痴呆的一个主要特征,并且早在轻度认知障碍(mild cognitive impairment, MCI)阶段已经有报道,而MCI通常是AD痴呆的先兆。虽然睡眠质量下降(包括与记忆巩固相关的睡眠参数)在健康老化中也很常见,但在MCI或AD型痴呆患者的下降严重程度明显加快。睡眠中断不仅会导致MCI患者的记忆恶化,还可能在潜在病理进展中起直接作用。
睡眠在记忆的长期巩固中起着积极作用。具体来说,慢振荡(slow oscillations, SO;大振幅波<1 Hz)和睡眠纺锤波(8-15 Hz)可以通过EEG测量,似乎对陈述性记忆至关重要。根据“主动系统巩固”理论,新编码的记忆在睡眠期间被重新激活,伴随着海马体中的锐波波纹事件(80-100Hz),并通过海马体和新皮层之间的协调对话重新分布到皮层长期存储网络。这种对话是由皮层SO和丘脑皮层快速纺锤波(12-15 Hz)之间的特殊耦合介导的,纺锤波最好发生在SO上升阶段和海马波纹聚集在快速纺锤波的波谷。慢纺锤波(8-12 Hz)是睡眠纺锤波活动的一种,其在记忆巩固中的作用还不太为人所知。
除了巩固方面,越来越多的证据表明,睡眠,特别是SO(慢振荡),会进一步促进皮质淀粉样β蛋白的清除,其中淀粉样β蛋白是一种参与AD发病机制的肽。因此,针对睡眠参数的干预可能提供一种治疗方法,不仅用于记忆巩固缺陷,还用于解决MCI患者阿尔茨海默病的进展,其中SO活动是有希望的靶点候选物。在睡眠期间应用慢振荡微弱经颅直流刺激(slow oscillatory weak transcranial direct current stimulation, so-tDCS; 频率< 1 Hz)提供了一种增强SO活动的非侵入性方法,这在健康年轻个体和老年个体中有所报道。这种刺激也会导致纺锤波活动增加,但不知道它是否改变了SO和快速纺锤波之间的交叉频率耦合,这被认为是睡眠期间记忆巩固的关键。so-tDCS导致的记忆改善已被反复证明,而一些研究没有发现任何改善或甚至发现了相反的影响。
这提出了以下关键问题:
(1)睡眠和记忆严重受损的MCI患者是否以及如何在睡眠期间从so、纺锤波活动以及它们的交叉频率耦合方面受益于so-tDCS;
(2)so-tDCS效应是否在行为上反映在记忆表现中。为了解决这些问题,我们在MCI患者午睡期间应用了so-tDCS,并评估了它对视觉识别任务中EEG衍生的睡眠特征和记忆表现的影响。因此,我们检查了这种非侵入性干预治疗的潜力,并对潜在的机制提供了新的见解。
2. 材料和方法
2.1 参与者
22名(10名女性,平均年龄71.2岁±8.79 SD;范围:50-81岁)从查利特大学医院神经内科记忆门诊招募的MCI患者参与了本研究。MCI患者(遗忘型;单域和多域)根据Mayo Clinic标准进行临床诊断。得分至少低于年龄教育程度匹配的健康人的相关量表得分的1 SD (即包括早期和晚期MCI)。相关子测试:总单词表、延迟回忆单词表/数字)或德语版听觉语言学习测试(Auditory Verbal Learning Test, AVLT),患者具有相对保留的一般认知,日常生活活动没有障碍,并且没有痴呆。
排除标准包括简易精神状态考试分数<24,严重未治疗的医学、神经和精神疾病史;睡眠障碍;酗酒或滥用药物;MRI扫描中发现脑部病变;摄入主要作用于中枢神经系统的药物(如抗精神病药、抗抑郁药、苯二氮卓类或任何类型的非处方安眠药,如缬草);非流利的德语能力。此外,通过贝克抑郁量表II (如果得分>19则排除),MRI排除主要的大脑病理,如脑肿瘤和以前的中风。此外,如果参与者至少有三个so-tDCS或假刺激blocks睡眠时间不够长,深度不够,那么他们就被排除在分析之外,这对应于睡眠阶段2或慢睡眠<22分钟。这是由于我们的刺激方案,该方案旨在防止在不适当的大脑状态(觉醒、睡眠第一阶段或REM睡眠)期间应用so-tDCS。
总的来说, 6名患者的数据不得不被排除。2名由于睡眠不足,3名无法完成电脑化任务,1名存在以前未被发现的精神障碍,最终有16名患者完成了实验。排除的患者除了受教育时间外,基线参数与该队列无差异(受教育时间p=0.048,其他都p>0.2;基线特征见表1),由于异常值(30年),被排除参与者的平均受教育时间更长。
表1受试者基线特征
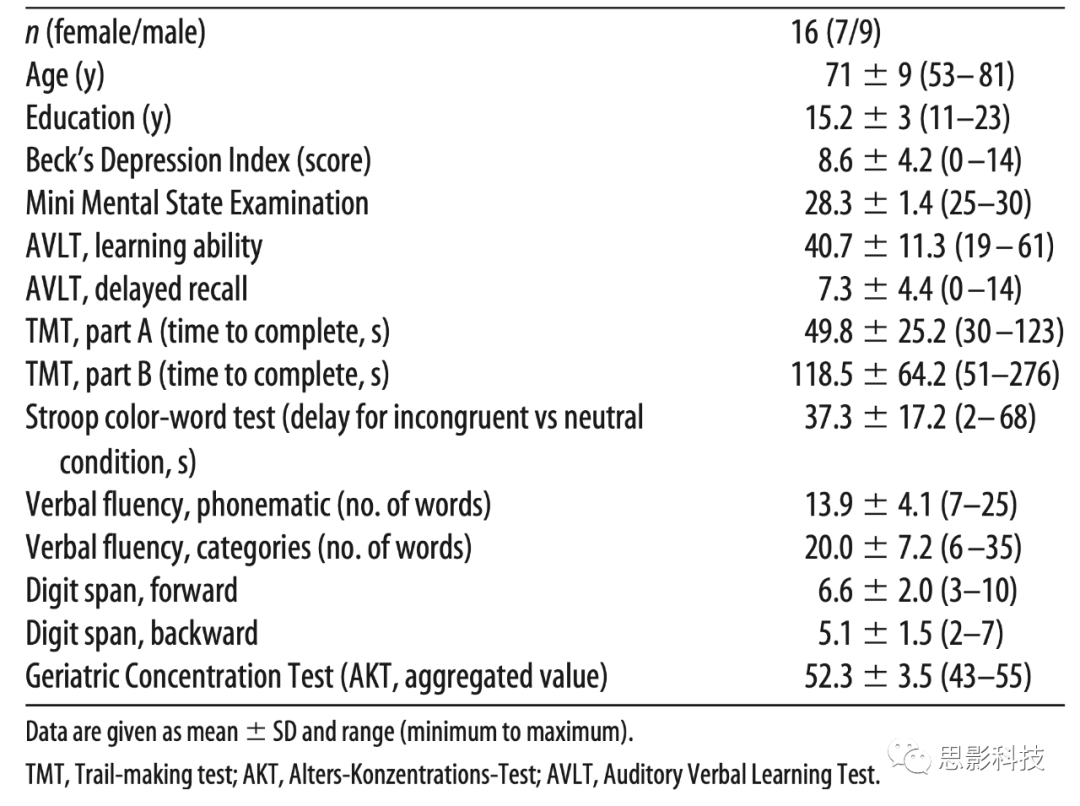
2.2 基线评估
对每位参与者进行了全面的神经心理学测试,用于评估总体认知状态,包括记忆表现(德语版听觉语言学习测试),工作记忆(数字广度),执行功能(Stroop颜色-单词测试),语言流畅性(雷根斯堡语言流畅性测试),加工速度和设置转换(试验制定测试第一部分和第二部分),选择性注意和集中。此外,使用了由CERAD-Plus开发的神经心理学测试组。测试时的情感状态使用积极和消极情绪量表。基线特征见表1。
此外,还有关于最近睡眠习惯的问卷(德语版的晨间-晚景-问卷),睡眠质量问卷(匹兹堡睡眠质量指数),白天睡眠问卷(Epworth嗜睡量表)和埃森关于年龄和嗜睡的问卷调查。每日睡眠日记和活动记录仪(GT3XActiGraph)用于监测实验午睡前7天的习惯性就寝时间和醒来时间。这些数据证实了参与者坚持规律的睡眠时间表。
2.3 研究设计
实验程序与Ldenbauer等人(2016年)相同。简而言之,患者在真刺激和假刺激条件下以平衡交叉设计进行测试(在第一次实验性午睡时n=8名参与者接受了so-tDCS,n=8名接受了假刺激),间隔至少2周以防止遗留效应。在实验性午睡之前,参与者在实验室里进行了适应性午睡。
所有的午睡都在德国柏林自由大学的睡眠实验室进行。在上午11:30到达时,参与者准备好EEG记录,然后测试了两个陈述性记忆任务(口头配对联想学习和视觉空间学习,包括图片和位置记忆),随后是程序性记忆任务(手指顺序敲击)。下午2:00,在一顿标准化的小餐和准备好so-tDCS后,参与者被要求尝试睡眠90分钟,然后在醒来30分钟后进行记忆测试。
在学习之前和午睡之后的恢复之前,注意力能力(注意力表现测试),情绪状态(PANAS量表),嗜睡(疲劳症状量表;视觉模拟量表)和激活(用于紧张的VAS)被评估以控制可能的混杂效应。实验过程的示意图见图1a。
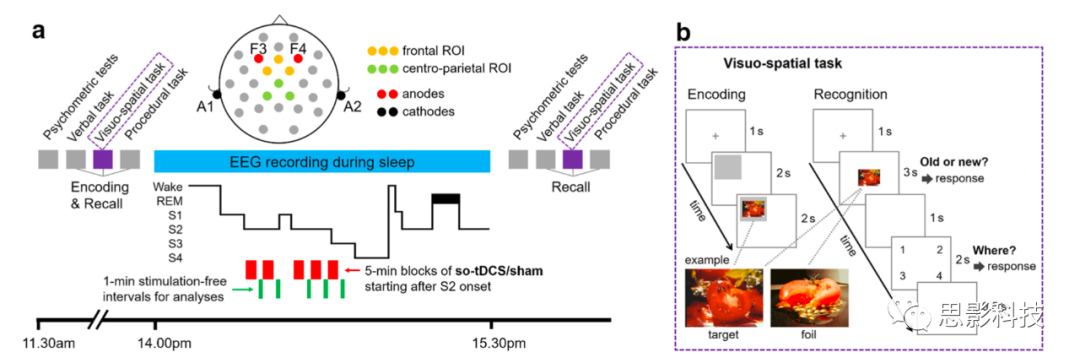
图1 研究设计。
a.在心理测量控制测试后,受试者按照指示的顺序学习语言、视觉空间和程序任务。在随后的90分钟内(下午2点至3点30分),记录脑电图,并应用慢振荡经颅直流电刺激(so-tDCS)或假刺激(受试者内部设计,随机顺序)。在午睡后30分钟进行记忆提取和心理测量控制测试。
b.视觉空间记忆任务的编码和识别实例。
2.4 so-tDCS
刺激方案与Ladenbauer等人(2016年)描述的相同。刺激电极(直径8毫米)位于国际10-20系统的额叶F3和F4两侧(安装在EASY帽中),参考电极放置在每个乳突(同侧;同样直径为8毫米)。阳极电流由电池驱动的刺激器(DC-Stimulator;NeuroConn;电流分流到双侧电极位置)并以0.75 Hz的频率正弦振荡(在0-262.5μA之间),导致0.522 mA/cm2的最大电流密度。电极电阻<5 kΩ。
so-tDCS在受试者进入稳定的非快速眼动(non-rapid eye movement, NREM)睡眠第二阶段后4分钟开始,5分钟一个block进行刺激,(至少)1分40秒的无刺激,作为block间的间隔。每一个1分钟无刺激间隔开始的标记(用于刺激诱导效应的立即分析)总是在每一个刺激周期结束后40秒手动设置,以从分析中排除未滤波的在线EEG信号中可见的强烈和持久的刺激诱导漂移(刺激间隔的分析将在下文中称为“1分钟无刺激间隔”)。如Ladenbauer等人(2016年)所述,5分钟刺激blocks 的数量(3–5个blocks,包括3)和中间无刺激间隔的持续时间取决于个体受试者的睡眠,因为在每个刺激block之后监测睡眠,并且每个刺激block仅在NREM睡眠第2、3或4阶段开始。如果受试者在so-tDCS/假刺激block后从睡眠阶段2、3或4进入睡眠阶段1 (即REM睡眠),甚至是清醒状态,我们延长了无刺激间隔,目的是在更深的睡眠阶段选择性地进行刺激。在每个无刺激间隔期间,进行在线睡眠评分,并延迟下一次刺激,直到受试者重新进入第二睡眠阶段1分钟。因为先前的研究表明,so-tDCS的影响主要取决于正在进行的大脑状态,该方案被选择用于解释老年人较高的睡眠碎片,以防止在不适当的大脑状态下(如觉醒、睡眠第一阶段或REM阶段)应用so-tDCS。
在假刺激期间,刺激电极被放置在与so-tDCS相同的位置,但是tDCS装置保持关闭。将与so-tDCS条件相同的标准应用于假刺激条件(第一个假刺激block在第二睡眠阶段开始后4分钟开始;对于随后的假刺激block,需要睡眠阶段2或慢波睡眠)。同样,每个假刺激block后的前40秒被排除在分析之外。在整个研究过程中,参与者不知道刺激条件。在完成所有与研究相关的程序后,他们被问及是否能够猜出在哪个实验性小睡中施加了刺激,以及他们在小睡中是否有任何感觉。
2.5 睡眠监测和预处理
在午睡期间,使用根据扩展的10-20国际EEG系统放置的Ag-AgCl环形电极,从26个头皮部位(FP1、FP2、AFz、F7、Fz、F8、FC5、FC1、FC2、FC6、C3、Cz、C4、T7、T8、CP5、CP1、CP2、CP6、P7、P3、Pz、P4、P8、O1和O2)记录EEG。FCz被用作接地。使用BrainAmp放大器系统(Brain Products)以500 Hz的采样速率记录数据,并在0.05至127 Hz之间进行带通滤波。所有的电极记录都参考了附着在鼻子上的电极。阻抗<5 kΩ。此外,根据标准睡眠监测记录下巴的EMGs以及水平和垂直EOGs。
在应用陷波滤波器(中心频率为50 Hz,带宽为5 Hz)后,对原始数据进行了半自动和视觉筛查,以消除受伪迹污染的EEG段。这一处理是用BrainVision Analyzer (Brain Products)软件完成的。
2.6 EEG分析
我们在每次so-tDCS和假刺激block后的1分钟无刺激间隔内进行了频谱和相位振幅耦合分析。根据受试者实际进行刺激或假刺激的次数,对三到五个间隔进行分析。
谱功率。使用快速傅立叶变换计算每个电极每1分钟无刺激间隔的频谱功率,最多11个重叠(5秒)无伪迹段,每个持续10秒。对应的间隔用于假刺激。在计算功率谱(频率分辨率为0.06赫兹)之前,对每一个10秒的EEG数据段应用汉宁窗。随后,平均功率(μV2)是在感兴趣的频带上计算的:SO(0.5-1 Hz)和快速纺锤波(12-15 Hz)。我们还考虑了慢纺锤波频率(8-12 Hz),用于与以前的结果进行比较。根据先前的研究,选择了这些频带的感兴趣地形区域(regions of interest, ROIs)。电极位点FC1、Fz、FC2以及CP1、Cz、CP2分别合并成两个ROIs,即额叶和中央顶叶。因此,平均谱功率反映了每个ROI电极的平均值。使用BrainVision Analyzer软件进行谱功率分析。
相位振幅耦合(Phase–amplitude coupling, PAC)。为了评估EEG信号中与记忆相关的振荡之间的时间关系,我们使用了基于MATLAB的FieldTrip工具箱和自定义的MATLAB函数进行了事件锁定分析。具体来说,我们通过应用以下程序,对额叶ROI (Fz、FC1、FC2)和中央顶叶ROI (Cz、CP1、CP2)的SO-to-spindle PAC进行了表征:
(i)基于已建立的检测算法,为每个受试者、条件和电极确定了SO(慢振荡)事件:
首先,EEG数据在0.16到1.25 Hz之间滤波(双通FIR带通滤波器,阶数=3个低截止频率周期)。仅使用无伪影数据,唤醒状态和REM睡眠期也被排除在事件检测之外。
第二,候选SO的周期被确定为滤波信号中两个连续的正到负过零点之间的时间。选择符合SO持续时间标准的事件(期间≥0.8 s且≤2 s,对应于0.5-1.25赫兹)。
第三,为剩余的候选SO确定事件振幅(两个正负零交叉之间的波谷-波峰振幅)。也符合SO振幅标准的事件(≥SO候选振幅的75%;即振幅最大的25%的事件)被认为是SO事件。最后,对所有事件从未过滤的原始信号中提取出锁定在滤波信号中SO 下降状态的无伪迹段(-2.5到+2.5 s)。
(ii)使用滑动(10 ms步长) Hanning锥形窗口(具有可变的频率依赖长度)计算每个事件段和通道在5-20 Hz (步长0.25 Hz)的时频表示(Time–frequency representations, TFRs) (FieldTrip工具箱的mtmconvol函数)。窗口长度总是由整整五个周期组成,以确保可靠的功率估计。然后将TFRs标准化为事件前基线的差值(EEG段的-2.5到-1.2秒),并按受试者、条件和ROI进行平均。
(iii)为了量化快速纺锤波功率的(正在调制的)SO和 (调制了的) 振荡波动之间的同步和锁定,我们计算了这些时间序列的相位值,并应用了同步指数。使用希尔伯特变换为每个提取的SO事件的所有时间点和相应的快速纺锤波功率波动计算相位值。纺锤波功率波动时间序列通过在各个频率上平均的TFR箱获得,并向上采样到500赫兹的采样频率。为了确保正确的相位估计,在调制SO事件(0.5-1.25赫兹;双通FIR带通滤波器,阶数=3个低截止频率周期)。然后计算每个事件段和电极的两个相位值时间序列之间的同步指数(synchronization index, SI)。所得的SI是复数,其半径(r)表示调制SO和调制振荡快速纺锤波功率波动之间的锁定强度,角度(φ)表示这些振荡之间的相移。换句话说,φ表示快速纺锤功率随时间变化最大的SO阶段。它是通过以下方式获得的:
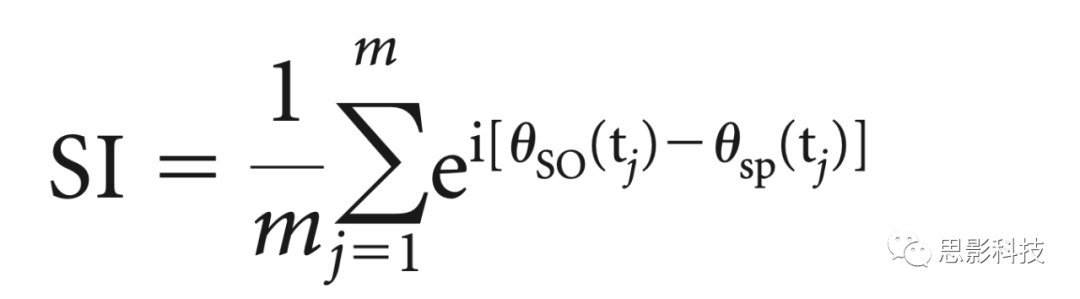
其中m是时间点个数,θSO(tj)是时间点tj时SO时间序列的相位值,并且θsp(tj)是时间点tj处快速纺锤功率时间序列波动的相位值。计算SI的时间间隔是SO中心的-1 s到1 s。每个条件和ROI的SIs分布在图3d中可视化。对于统计分析,SIs按受试者、条件和ROI进行平均。

图3 SO与纺锤波功率之间的相位振幅耦合。
a. EEG平均值。
b. TFRs锁定到SO事件并平均每个条件。
c.在快纺锤波(12-15Hz,上)和慢纺锤波(8-12Hz,下)频率范围的调制SO范围内,经滤波后的TFRs的事件锁定平均功率的时间过程。
d. SI角直方图。
e.两种情况下每个受试者(细线)和跨受试者(粗线)的SIs平均值。
睡眠结构。睡眠结构,包括在不同睡眠阶段花费的时间和比例,是基于多导睡眠图标准确定的。为此,EEG数据被下采样到250赫兹,并在睡眠阶段1、2、3和4以及REM睡眠、清醒期或运动伪影中,通过Schlafaus软件(Steffen Gais)手动评分30秒的EEG段。由于EEG信号中的严重伪影,so-tDCS期间的段没有评分。同样,假刺激中的相应时期也没有评分,以获得可比较的睡眠时间和比例。在10秒的时间段内,对1分钟无刺激间隔(急性刺激的5分钟blocks之间)进行评分。
2.7 记忆任务
所有记忆任务都是用Presentation软件进行,平行版本被用于两个实验性午睡阶段的所有任务。在Ladenbauer等人(2016年)中,所有记忆任务也被执行过。在视觉空间和语言记忆任务中,受试者被要求记忆项目以备日后回忆,但没有推荐具体的策略。视觉空间和语言记忆任务中使用的刺激没有重叠。
我们将视觉识别记忆作为主要的行为测量方法,因为它在AD早期受到影响,是/否识别表现允许可靠地预测不同组 (AD,MCI,健康对照),并且与回忆范例相反的识别允许检查所有项目,而不仅仅是明确回忆的项目。为了与以前的研究进行比较,我们额外评估了位置回忆和联想词对回忆。
视觉空间记忆任务。视觉空间记忆任务由38幅中性图片(来自国际情感图片系统的物体、植物、场景和风景)组成,在屏幕上4个可能的象限中的1个随机出现2秒钟,间隔1秒钟(见图1b)。为了解释首因效应和近因效应,在分析中加入了另外四幅图片(两幅在开始,两幅在结束),但忽略了它们。参与者被要求记住图片(图片记忆)和它们的位置(位置记忆)。在识别测试过程中(睡眠前后),每张图片(38张研究过的图片和38张随机排列的新图片)显示在屏幕中央(3秒钟),同时参与者通过按下按钮指示他们是否识别了每张图片(是表示“旧”决策,否表示“新”决策)。如果参与者认识到一个项目(“旧”决策),那么他们还需要指出他们认为图片是在采集过程中出现在哪个象限。
该任务中的“旧/新”决策导致四种可能的响应类别:命中(正确的“旧”判断)、正确的拒绝(正确的“新”判断)、错误的警报(不正确的“旧”判断)和错过(不正确的“新”判断)。作为图片识别记忆准确性的衡量标准,正确回答的百分比计算如下:命中比例+正确拒绝的比例。此外,通过计算命中和误报的比例之和,考虑了潜在的反应偏差。
为了位置记忆的准确性,正确和错误检索的图片位置都被考虑并计算如下:正确检索的位置数/命中数-错误检索的位置数/命中数。由于技术问题,一名参与者的数据被排除在本任务的分析之外。
考虑到复杂图片刺激(场景和风景)的高比例以及目标和衬托的相似性,图片识别表现包括回忆和熟悉过程,这两种都已被证明在MCI中受到影响,因此具有临床相关性。
口头记忆任务。参与者观看了40个语义相关的德语单词对(类别-实例对:例如,水果-香蕉),这些单词对在屏幕中央出现了5秒钟,中间间隔为100毫秒。另外还呈现了四个单词对(两个在开头,两个在结尾),以防止首因-近因效应。编码后,进行初始线索回忆测试。类别名称(线索)出现在中心位置,参与者在指示(10秒内按下按钮)是否记住各自的刺激(实例)词后,被要求大声说出各自的刺激(实例)词。随后,正确的单词对显示了2.5秒。这个初始线索-回忆测试提供了一个额外的学习机会,使得在随后的线索回忆测试中,~60%的回答正确。这个即刻线索-回忆和延迟线索-回忆测试(睡眠后)在没有额外呈现正确单词对的情况下进行。单词对以不同的随机顺序出现,以防止在每个编码和回忆测试中的连续学习。记录被试的言语反应,并根据即时回忆和延迟回忆中正确目标的比例分别获得线索回忆成绩。
此外,我们测试了刺激对干扰率的影响(午睡时段中对前一时段相同类别的正确反应的不正确实例词的比例)。来自一名参与者的数据被排除在该任务的分析之外,因为她未能遵循任务说明。
请注意,我们的口头任务不同于Marshall等人(2006)和韦斯特贝里等人(2015)中使用的任务,因为我们的词对列表旨在实现两个实验性小睡的词对之间的高度可比性,并排除情感词。尽管词对列表之间的可比性因类别-实例(例如,水果-香蕉)结构而增加,但与以前的研究相比,词对表现出更强的语义关联。
程序性任务。一个改编自Walker等人(2002)的连续手指敲击任务被用来研究so-tDCS对程序记忆的影响。参与者被要求在30秒的时间间隔内,以尽可能准确和快速的方式反复敲击非优势左手在屏幕上显示的五位数序列(例如4-2-3-1-4)(试验)。在午睡前测试(学习)中,参与者进行了12次测试,中间30秒休息间隔。午睡后测试(检索)包含四次有休息的试验。学习和检索测试的表现分别由最后三次试验中的平均正确敲击序列决定。四名参与者未能完成这项任务,因此被排除在这项任务的分析之外。
2.8 统计分析
谱功率。使用具有随机截距的线性混合模型(linear mixed model, LMM)评估了五种结果测量(即额叶和中央顶叶SO、纺锤功率,以及额叶纺锤功率)中两种刺激条件(so-tDCS和假刺激)之间的差异。选择这个模型是为了解释睡眠生理学中典型的个体差异以及不同受试者和条件下的不等数量的频谱功率数据点(根据个体受试者的睡眠情况,应用三到五个so-tDCS和假刺激blocks)。这些不平等是由于在不适当的大脑状态下不进行so-tDCS。
简而言之,模型描述如下:
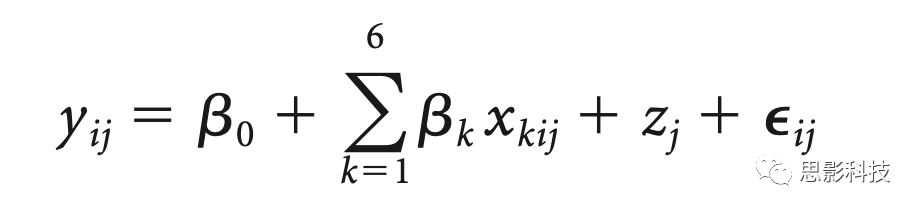
其中yij指参与者j∈{1,2,…,16}在间隔i∈{1,2,3,4,5}下log变换后的谱功率值。β0是固定截距,β1 ,…, β6是对应于刺激自变量的回归系数,x1ij∈{0,1},基线,x2ij,(居中)时间,x3ij=i-3,(居中)时间的平方,x4ij=(i-3)2,时间×刺激,x5ij=(i-3) x2ij,时间的平方×刺激,x6ij=(i-3)2 x2ij。特定被试的随机截距是zj给出的,εij是残差(或随机误差);也就是说,五个时间点(每个刺激block后1分钟无刺激间隔)是嵌套在受试者中的一级水平单元(二级水平单元)。该模型假设斜率是相似的(没有随机斜率模型),因为之前没有证据表明刺激效应(斜率)对睡眠生理学的个体间差异。作为协变量的基线变量(x2ij)分别用于调整每个频带的基线差异。该变量采用从第一次刺激/假刺激block前的1分钟间隔计算的受试者特异性对数变换频谱功率值。由于谱功率数据不呈现正态分布,因此在应用LMM之前对其进行了对数变换。请注意,刺激和基线变量的值在不同时间间隔内没有变化。平方中心时间变量(x4ij)用于测试SO和纺锤波功率随时间间隔的曲线进程。通过相互作用时间×刺激,我们评估了刺激条件和相互作用时间的平方×刺激之间的曲线斜率是否不同,包括刺激条件之间的曲线形状是否不同。
PAC(相位振幅耦合)。我们使用双尾配对样本t检验(组水平统计)测试了刺激引起的TFR中显著的事件锁定功率变化。为了校正多重比较(-1.2s到+1.2 s × 5-20赫兹),在FieldTrip中应用了一个基于聚类的置换程序。团块定义的初始阈值设置为p<0.025,聚类内总和t值显著性的最终阈值设置为p<0.05。
为了评估(圆形)SI角是否以特定的平均值不均匀分布,我们应用了V检验。使用这个测试,替代假设H1指出,人口聚集在一个已知的平均方向。在当前情况下,我们期望在SO上升状态附近出现最大快速纺锤波功率;也就是说,聚集在0°左右。
此外,我们计算了结果向量长度,它表明了SI角的集中程度。对于特定的条件和ROI,计算方法如下:

其中φj是被试j∈{1,2,…,n}的SI角。
睡眠结构。为了评估so-tDCS对睡眠结构的影响,对整个午睡期间和1分钟无刺激间隔期间不同睡眠阶段所花费的时间比例(单位为%)进行了t检验(或Wilcoxon符号秩测试)。
记忆任务。通过重复测量方差分析(repeated-measures ANOVA, rmANOVA)测试了so-tDCS对记忆任务中保持表现的影响,包括受试者内因素刺激(so-tDCS和假刺激)和时间点(午睡前和午睡后)。适当时应用了自由度的Greenhouse-Geisser校正。
【关于校正:当违背了球形假设条件时,需要进行epsilon(ε)校正。当 epsilon(ε)接近 1 时,Greenhouse-Geisser 校正倾向于低估 epsilon(ε),即保守校正,而 Huynd-Feldt 校正倾向于高估 epsilon(ε),即更自由的修正。通常,建议使用 Greenhouse-Geisser 校正,尤其是当估计的 epsilon(ε) 小于 0.75 时。但是,如果估计的 epsilon(ε) 大于 0.75,一些统计学家建议使用 Huynd-Feldt 校正。在实践中,两种修正都会产生非常相似的修正,因此如果估计的 epsilon(ε) 大于 0.75,可以使用任何一种。】
使用SPSS进行记忆任务、功率、睡眠结构的统计分析;使用FieldTrip、CircStat MATLAB工具箱以及自定义MATLAB函数对PAC行为进行统计分析。双边显著性水平α在所有分析中被设置为0.05。给定感兴趣的主要参数的多个测试[n=5;视觉识别表现(正确分数百分比)和四种与记忆相关的EEG频谱功率测量,即额叶和中央顶叶SO和快速纺锤波功率],我们采用Benjamini-Hochberg校正来控制在q=0.05的错误发现率。校正后的显著性水平在结果部分用q*表示。为了校正统计TFR分析中的多重比较,应用了基于聚类的置换方法。行为效应的报告效应大小是偏η2(随后缩短为η2)。此外,我们利用边际均值差计算了刺激对EEG功率影响的LMM(线性混合模型)的模型标准化效应大小(Cohen’s d),并基于SEs计算了SD。所有其他检验和比较都与次要假设有关,p值应该在探索性分析的框架内进行解释。
如果您对脑电等数据处理感兴趣,欢迎浏览思影科技网站及公众号了解相关的其他课程。具体可浏览以下链接(可添加微信号siyingyxf或18983979082咨询,另思影提供免费文献下载服务,如需要也可添加此微信号入群):
南京:
第二十三届脑电数据处理入门班(南京,4.23-27)
北京:
第二十五届脑电数据处理入门班(北京,5.16-20)
上海:
第三届脑电机器学习数据处理班(Matlab版,上海,5.15-20)
第三十六届脑电数据处理中级班(上海,5.28-6.1)
重庆:
第二十二届近红外脑功能数据处理班(重庆,5.24-29)
数据处理业务介绍:
思影科技EEG/ERP数据处理业务
思影科技近红外脑功能数据处理服务
思影科技脑电机器学习数据处理业务
思影数据处理服务六:脑磁图(MEG)数据处理
思影科技眼动数据处理服务
招聘及产品:
思影科技招聘数据处理工程师 (上海,北京,南京)
BIOSEMI脑电系统介绍
目镜式功能磁共振刺激系统介绍
3.结果
我们分析了16例MCI患者(7例女性,平均年龄70.6岁±8.9 SD),他们在午睡90分钟前后接受了记忆任务测试,测试中使用了so-tDCS或假刺激(两阶段,平衡交叉设计)。实验的示意图如图1所示。我们专注于视觉识别记忆,它的损伤发生在AD病程早期,因此构成MCI介入治疗的敏感靶点。为了与以前的研究进行比较,我们额外评估了词对回忆。
我们首先询问so-tDCS是否对与记忆相关的睡眠测量有有益的影响。为此,我们重点研究了在长达5个so-tDCS/假刺激blocks后持续1分钟的无刺激间隔期间,通过EEG测量的对SO和快速纺锤波的即时影响。我们评估了这些振荡的功率以及它们的功能耦合。基于以前的研究,我们分别对额部和中央顶叶的ROIs进行了分析。此外,我们评估了额叶慢纺锤波功率,并量化了睡眠结构变化。然后我们研究了刺激如何改变陈述性记忆的表现,最后探索了表现的变化和睡眠测量之间的关系。
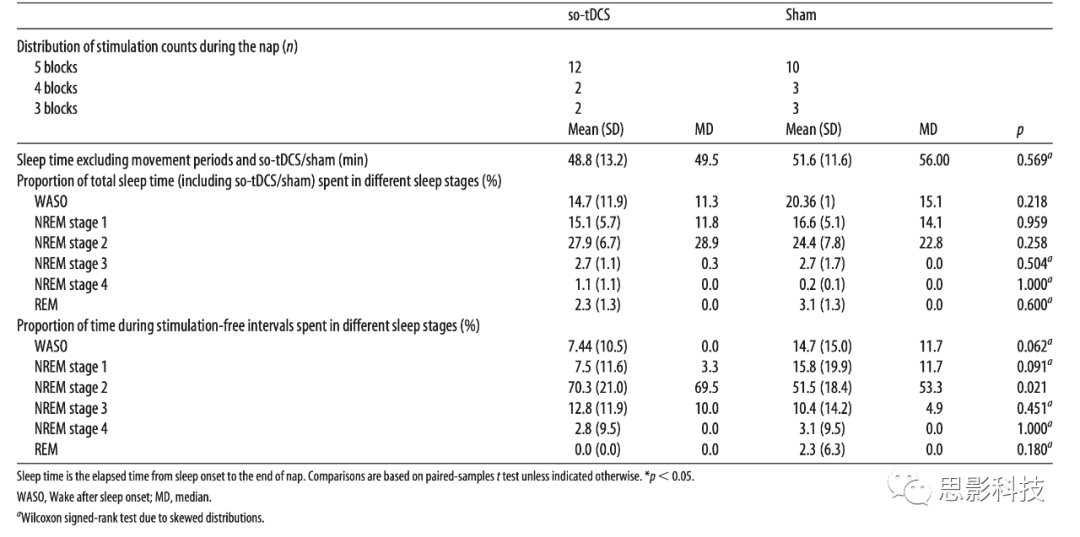
so-tDCS/假刺激blocks的数量在不同的疗程之间可能会有所不同,因为我们通过确保每个刺激block之前进入睡眠阶段2或更深来考虑个体受试者的睡眠(状态依赖的刺激)。在参与者接受的so-tDCS/假刺激blocks的数量方面,没有观察到显著差异(见表2,Wilcoxon符号秩检验:p=0.453)。所有患者对这种刺激都耐受良好。他们没有报告任何感觉,除了一名患者表示有刺痛感。实验后的汇报表明,大多数受试者无法猜出在哪个午睡时段应用了so-tDCS (n=14人回答“不知道”,2名受试者正确猜到了so-tDCS午睡)。考虑到实验前的睡眠时间表和睡眠持续时间,刺激条件之间没有明显差异(所有p>0.2)。
表2 so-tDCS/假刺激间隔计数和睡眠结构
3.1 对记忆相关睡眠测量的影响
3.1.1 频谱功率
为了分析刺激对频谱功率记忆相关频带的影响,我们使用了LMM(线性混合模型)方法,该方法解释了睡眠生理学中的个体差异和受试者之间不相等的观察次数(3-5个so-tDCS/假刺激blocks)。LMM分析显示,在午睡期间,额叶和中央顶叶的SO (0.5-1 Hz)功率有显著的so-tDCS相关增强[刺激,平均差异,额叶:0.28,95%置信区间(confidence interval, CI):0.16-0.40,d=1.16,p<0.001,q1=0.01;中央顶叶:0.19,95% CI:0.06-0.31,d=0.70,p=0.006,q3=0.03;图2)。这种增强不能用基线SO功率(在第一次so-tDCS/假刺激block前1分钟内)来解释,在该基线so-tDCS和假刺激条件之间没有观察到显著差异(额叶:t(15)=1.65,p=0.121;中央顶叶:t(15)=1.20,p=0.249)。此外,基线SO功率与刺激blocks后的SO活动无显著相关性(基线,额叶:β2=-0.082,SE=0.168,p=0.628;中央顶叶:β2=-0.145,SE=0.206,p=0.483)。关于睡眠期间1分钟无刺激时间间隔内SO功率的过程,与条件无关,我们没有观察到显著的线性变化(时间,额叶β3=0.027,SE=0.029,p=0.353;中央顶叶:β3=0.027,SE=0.033,p=0.408),但呈倒U型关系,这种关系比中央顶叶更强(时间的平方,β4=-0.061,SE=0.027,p=0.025)比额叶部位(时间的平方,β4=-0.040,SE=0.024,p=0.092)。在不同条件下(时间×刺激和时间的平方×刺激相互作用:所有p>0.2)。
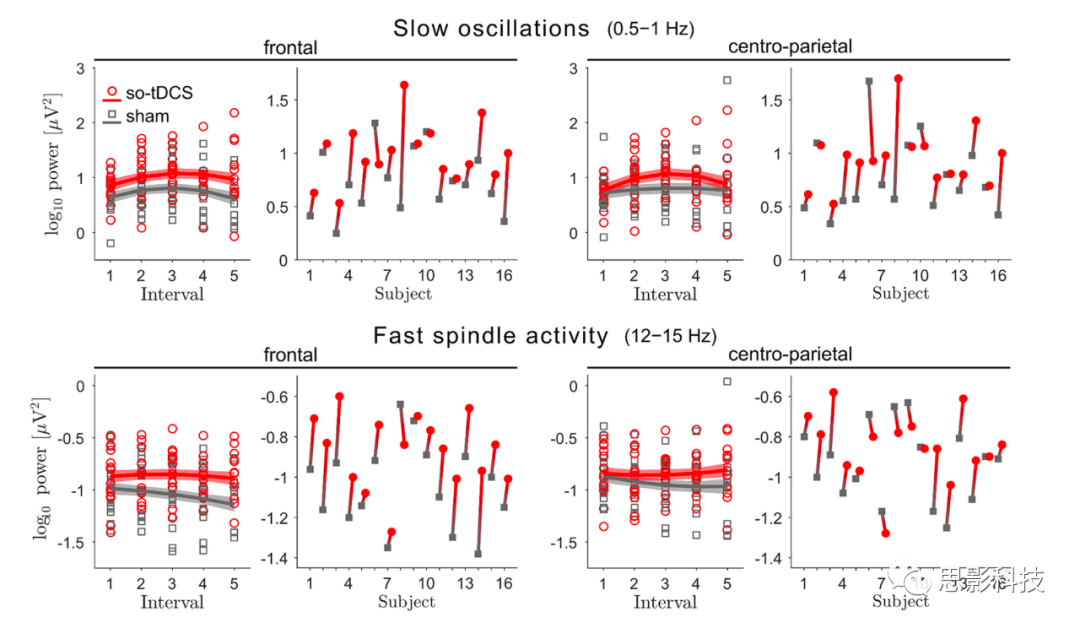
图2 so-tDCS提高了SO和快速纺锤波频率范围内的EEG功率
这种增强的so-tDCS效应并不局限于so波段。对于快速纺锤波功率(12-15Hz),LMM分析也显示了显著的刺激效应(刺激,平均差异,额叶:0.14,95% CI:0.07-0.21,d=1.02,p<0.001;q2=0.02;中央顶叶:0.07,95% CI:0.003-0.14,d=0.50,p=0.041,q5=0.05)表明与假刺激相比,so-tDCS后的功率增加。这些so-tDCS诱导的功率增加也不能用基线期间的快速纺锤波功率来解释,因为在基线期间,so-tDCS和假刺激之间没有显著差异(额叶t(15)=1.84,p=0.086;中央顶叶:t(15)=0.88,p=0.393)。然而,我们发现基线快速纺锤波功率与该频率范围的功率在随后的刺激自由间隔期间额叶(基线,β2=0.463,SE=0.122,p<0.001)和中央顶叶(基线,β2=0.392,SE=0.146,p=0.010)显著相关。
我们进一步研究了刺激对额叶慢速纺锤波功率(8-12Hz)的影响,因为之前在年轻受试者中的一项研究发现so-tDCS诱导的慢纺锤波带增加,但对快纺锤波功率没有影响。在本研究中,与假刺激相比,so-tDCS后额叶慢纺锤波功率显著增加(刺激,平均差异,0.10;95% CI: 0.04-0.16,d=0.82,p=0.001)。这里,基线额叶纺锤波功率在so-tDCS和假刺激条件之间没有显著差异(t(15)=1.11,p=0.287),但是,与快纺锤波功率一致,so-tDCS/假刺激block后无刺激间隔期间基线慢纺锤波功率与该频率下的功率显著相关(基线,β2=0.674,SE=0.112,p<0.001)。在快纺锤波频率范围和慢纺锤波频率范围内,没有发现对功率的进一步显著影响(所有p>0.1)。
3.1.2 PAC
为了评估SO(慢振荡)和纺锤波的功能耦合,我们采用了一种分析方法,研究纺锤波振荡的振幅(功率)是否被SO的相位(相位-振幅耦合)系统地调制。使用事件锁定分析,我们特别检查了假设的SO和快速纺锤体的嵌套。我们根据已建立的检测算法识别了EEG中的SO事件,并将事件段的TFRs与SO波谷的中心对齐。在相应的(事件锁定的)TFR中,SO和纺锤波的PAC作为功率调制随时间出现。为了确保可靠的PAC结果,不得不将四名患者排除在该分析之外,因为他们仅表现出极少量的SO事件(每个电极<10个)。因此,最终分析包括12个。
我们发现,在以事件为中心的SO波谷之后的SO上升阶段(下降阶段),so-tDCS导致中心顶叶快纺锤波功率显著增加,在SO波谷之前的SO上升阶段,中心顶叶慢纺锤波功率也显著增加(图3a-c)。可以注意到,在so-tDCS条件下,慢纺锤波功率的调制导致了明显更强的振荡行为,相对于快速纺锤波功率振荡其相位延迟了~250毫秒(图3c)。在额叶ROI,我们没有观察到刺激对以这种方式评估的PAC的显著影响。
我们使用SI以事件方向的方式进一步研究了SO和快速纺锤波之间的这种耦合,它测量了调制SO和调制振荡纺锤波功率波动之间的锁定和相移强度。图3d和e所示的SIs强调由于刺激引起的假设的记忆相关PAC的增强。SI角的总体分布指示了SO的相位,在该相位处优选出现快速纺锤波。与假条件(图3d)相比,这种分布显示出更强的接近于零(相位同步)的刺激峰值,并且通过合成矢量长度(so-tDCS:0.20,假刺激:0.16)测量更集中,并且更大比例的SI角在第四象限(270-360°,so-tDCS:35%,假刺激:29%),表明纺锤波功率峰值优选出现在SO的后期上升阶段。受试者平均SI角的统计数据证实了这一点(图3e),其中12个中有8个(so-tDCS)和5个(假刺激)位于第四象限,其合成向量长度(表示受试者的集中程度)为0.89(so-tDCS)和0.58(假刺激)。V检验结果进一步表明,对于刺激条件,受试者平均SI角基本上更紧密地集中在接近0°的位置(so-tDCS: V=10.16,p<0.00002,假刺激:V=6.84,p<0.003)。
对于额叶ROI,我们观察到类似的(但较弱的)刺激下SO和快速纺锤波PAC增强,如受试者平均SI角(so-tDCS: V=8.50,p<0.0003,假刺激:V=5.67,p=0.01)和相应的合成向量长度(so-tDCS: 0.71,假刺激: 0.52)。
3.1.3 睡眠阶段
表2总结了午睡和1分钟无刺激间隔期间不同睡眠阶段的总睡眠时间。在总睡眠时间和不同睡眠阶段花费的时间方面,没有发现条件之间的显著差异(所有p>0.2).然而,对于1分钟的无刺激间隔,两两比较在NREM睡眠阶段2中产生了显著差异(t(15)=2.57,p=0.021,平均差异18.86,95% CI:3.22-34.51)。与假刺激相比,睡眠第2阶段在so-tDCS后有所增加,而睡眠开始后的唤醒时间和NREM睡眠第1阶段呈趋势性减少(Wilcoxon符号秩检验:p=0.062和p=0.091)。
综上所述,MCI患者的so-tDCS显著增加了SO功率,增强了快和慢纺锤波频率范围内的功率。PAC分析进一步揭示,so-tDCS导致SO和快速纺锤波功率之间更强的同步,特别是在SO上升阶段后期增加纺锤波功率。这些有益的so-tDCS效应也反映在1分钟无刺激间隔期间的睡眠结构中,与假条件相比,睡眠阶段2增加,睡眠阶段1和觉醒阶段呈减少趋势。
3.2 对记忆的影响
为了控制对记忆表现的潜在混杂影响,我们评估了午睡前后自我报告的情绪、激活、嗜睡和注意力。午睡前后无显著差异(p>0.1)。同样,我们也没有发现注意力、情绪和激活的刺激依赖性变化(p>0.2),但自我报告的困倦有增加的不显著趋势,这由so-tDCS午睡后疲劳症状量表(身体困倦)指数表示(F(1,15)=3.5, p=0.082)。
我们测试了so-tDCS效应是否也反映在MCI患者的视觉记忆表现中(n=15)。鉴于(轻度)so-tDCS对嗜睡的影响,我们将嗜睡作为协变量纳入各自的记忆表现分析(ANCOVA)。根据图片识别准确度(正确百分比:命中率+正确拒绝率),我们发现so-tDCS对于视觉记忆的显著效应(刺激×时间点交互:F(1,12)=5.34,p=0.039,q4=0.04;整个午睡期间的表现变化,单位为%:so-tDCS,2.89,95% CI:0.24-5.54;假刺激,-0.96,95% CI:-5.10-3.18, η2=0.308;午睡前和午睡后的分数也见图4)。我们进一步测试了不同条件下午睡前的差异和可能的反应偏差。午睡前的视觉识别表现在不同疗程没有差异(t(14)=0.38,p=0.712),没有观察到上限效应(午睡前正确百分比:so-tDCS,83.86,95% CI:78.9-88.8;假刺激,82.94,95% CI:73.6-91.5;然而,一名患者在假刺激条件下达到100%)。关于反应偏差,如命中率和误报率之和所示,发现与假条件相比,使用so-tDCS的午睡后的反应不太保守(F(1,12)=11.83,p=0.005, η2=0.496)。然而,通过对命中率和误报率分别测试so-tDCS效应来更详细地检查这种效应,显著的效应仅在命中率方面明显(F(1,12)=14.55, p=0.002, η2=0.548),误报率不显著(F(1,12)=2.54, p=0.137, η2=0.175)。此外,我们在分析中评估了so-tDCS对视觉记忆的影响,而没有校正睡意(rmANOVA)。此处,观察到与假刺激相比,经so-tDCS后的保留表现有所改善,但未能达到显著水平 (F(1,14)=3.58,p=0.079, η2=0.204)。关于刺激和时间点对视觉识别表现的主要影响,没有明显的显著影响,但是出现了治疗主效应的趋势(刺激,F(1,12)=3.80,p=0.075)。
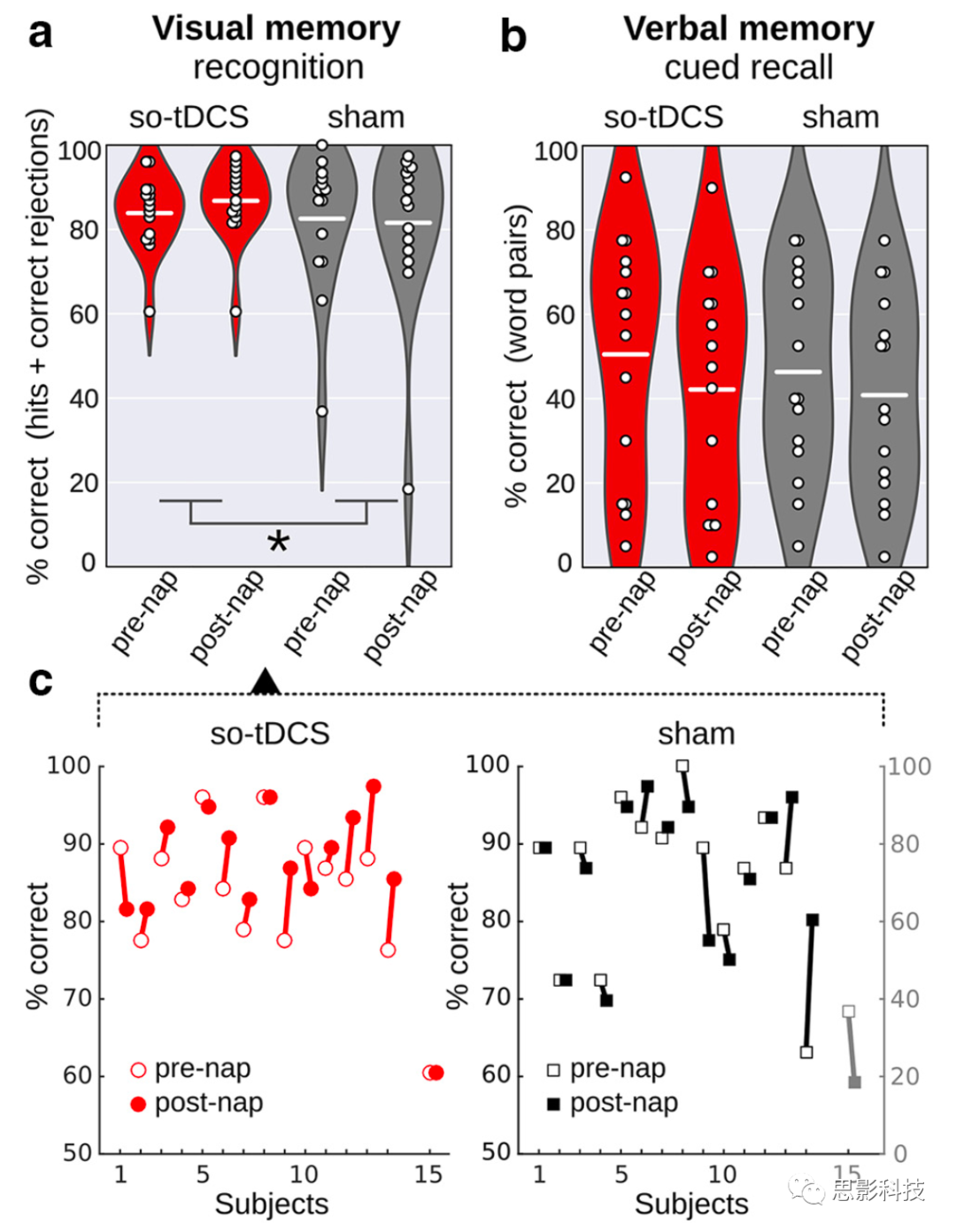
图4 so-tDCS与sham条件下声明性记忆任务的保持性能。
a, b,对so-tDCS(红色)和sham(灰色)在午睡前和午睡后在图像记忆子任务(a)中的识别表现和言语记忆任务(b)中的提示回忆表现。
c, so-tDCS(左)和sham(右)条件下个体午睡前后的图像识别表现。
位置检索表现不受so-tDCS的影响(刺激×时间点交互:F(1,12)=0.01,p=0.913, η2=0.001;整个午睡期间的表现变化,单位为%:so-tDCS,8.37,95% CI:-16.62到-0.12;假刺激,-4.95,95% CI:-16.55至6.65)。只发现了与刺激条件无关的午睡后空间记忆的下降(午睡前后的记忆变化;主效应时间点:F(1,12)=6.18,p=0.029;午睡前百分比:-12.87,95% CI:-35.84到10.10,午睡后百分比:-19.53,95% CI:-39.50至0.44)。
为了与以前的研究进行比较,我们还研究了so-tDCS对单词配对相关学习任务(语言记忆)中记忆成绩的影响。我们没有观察到so-tDCS对暗示回忆表现的影响(分析控制了嗜睡,刺激×时间点交互:F(1,12)=2.27,p=0.156, η2=0.149,n=15),但MCI患者在午睡前至午睡后表现出明显的独立于刺激条件的回忆能力下降(主效应时间点:F(1,12)=12.96,p=0.003;午睡前%: 45.9±6.6;午睡后%: 39.1±6.1)。午睡前的基线语言记忆表现在so-tDCS和假刺激之间没有差异(t(14)=1.03,p=0.322)并且没有观察到上限效应(平均午睡前正确得分百分比:so-tDCS,50.5,95% CI:35.4-65.6;假刺激,46.3,95% CI:33.0-59.7)。
为了确定so-tDCS效应的特异性,除了陈述性记忆任务外,还评估了程序性记忆任务。没有注意到主效应或相互效应的影响(所有p>0.5)。
总之,在校正了混杂变量嗜睡之后,so-tDCS对行为水平的影响揭示了对图片识别表现的有益影响。在位置记忆子任务、语言记忆任务或程序记忆任务中没有观察到so-tDCS的影响。
3.3 睡眠测量和记忆表现之间的关系
为了研究刺激诱发的睡眠测量变化(SO和纺锤波功率变化以及睡眠阶段)与视觉记忆表现变化之间的关系,我们将刺激条件下的睡眠测量差异与so-tDCS和假刺激条件下的视觉识别(午睡前至午睡后)表现变化的差异联系起来。对于功率测量和睡眠阶段,没有发现显著的相关性(所有p>0.3)。
最后,我们研究了中心顶叶SO和快速纺锤波之间的耦合(由SI测量)是否与视觉任务表现的变化有关。我们发现so-tDCS条件下正的“午睡后-午睡前”的任务表现差异往往与同步的SO和快速纺锤体PAC相关(SI角接近于0),而在假刺激条件下没有观察到这种关系(图5a)。
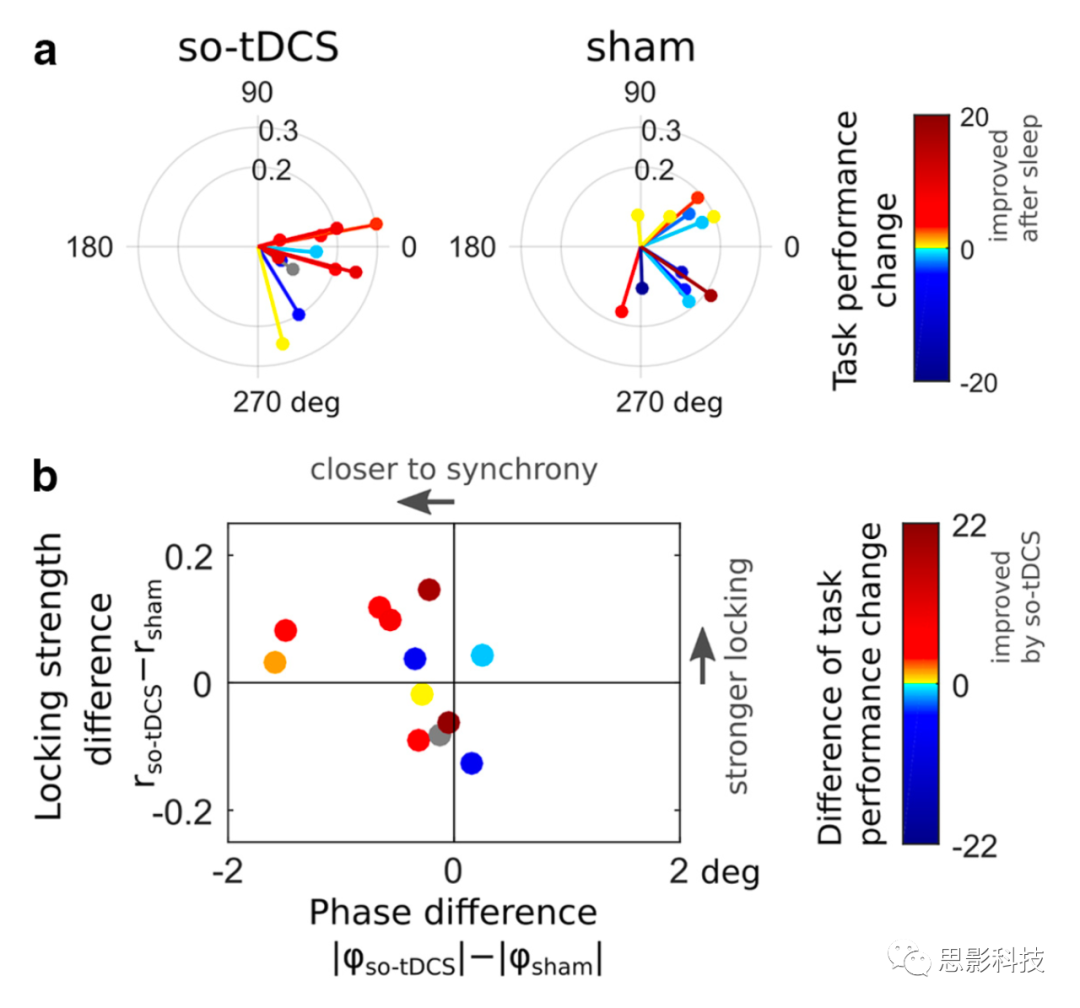
图5 SO与快速纺锤波相位振幅耦合和视觉记忆任务表现之间的关系。
a.受试者根据中央顶叶ROI测量的平均SI值。
b.受试者不同条件下的SI半径差异(表明锁定强度的变化)与绝对SI角的差异。
考虑刺激引起的PAC变化与视觉识别性能的关系,考虑到相位差(SI角度)和锁定强度(SI半径),so-tDCS带来的记忆性能改善往往伴随着SO与快速纺锤波功率之间更强的同步(SI相位)(图5b)。之前已经发现,SO上升阶段(事件中心下降阶段之后)的快速纺锤波功率与(口头)记忆表现相关;因此,我们另外应用了一个非常相似的措施(快速纺锤波功率峰值和它在SO上升阶段的时间)。我们发现,快速纺锤波功率峰值或其时间(与SO上升阶段的绝对时间差)与刺激引起的视觉任务表现变化没有相关性(在条件内,所有Pearson 's r绝对值小于0.27,所有p >0.4)。
总结这一部分,刺激引起的视觉记忆的改善与整体SO或纺锤波功率的变化没有显著的相关性,而是与SO和快速纺锤波功率波动之间的同步性增强有关。
4.讨论
鉴于越来越多的证据表明MCI患者睡眠中断和记忆减退之间存在联系,我们研究了特定的记忆相关睡眠特征——特别是SO(慢振荡)、快速纺锤波和这些振荡之间的耦合——是否可以在MCI患者白天小睡时通过so-tDCS增强。此外,我们打算通过刺激促进该患者组的视觉记忆巩固。我们第一次在MCI患者中发现,so-tDCS显著增加SO和纺锤波功率。重要的是,我们证明了so-tDCS通过以下方式导致内源性SO和纺锤波耦合增强:纺锤波功率在去极化SO上升阶段显著放大,并且SO和快速纺锤波功率信号之间的同步性更强。此外,我们发现视觉记忆性能的提高往往与SO和快速纺锤波功率之间更强的同步性有关。
该研究的一些局限性值得注意:首先,与假刺激情况相比,患者在午睡后感觉更困倦。在我们之前的研究中,在健康的老年人中也发现了这种对嗜睡的影响,而之前没有其他在睡眠中应用so-tDCS的研究报告过这种影响。我们不能排除在午睡后调查之前,由于so-tDCS导致的SO活动增加持续存在,尽管这是非常不可能的。然而,请注意,我们对嗜睡进行了统计控制,以排除其对记忆表现的潜在影响。其次,为了分析so-tDCS对SO和纺锤波之间耦合的直接影响,由于研究设计的原因,可以使用数量相当有限的EEG数据(最多五个1分钟无刺激间隔)。此外,尽管SO、纺锤波及其时间协调似乎是记忆巩固所必需的,但其他神经生物学过程(如BDNF释放)可能也有贡献,可能不受so-tDCS的调节。我们研究的另一个局限性是样本量太小,这可能解释了EEG和记忆效应之间缺乏显著相关性的原因。
总结:越来越多的证据表明,睡眠中断在阿尔茨海默病(AD)的发展过程中起着至关重要的作用,睡眠似乎是这种疾病治疗的靶点,特别是在对抗记忆衰退方面。这项研究证明了轻度认知障碍(MCI)患者在睡眠期间进行无创脑刺激的潜力,并推进了我们对其机制的理解。该文首次提供了证据,证明慢振荡经颅刺激可增强记忆相关脑振荡之间的跨频耦合功能,并改善MCI患者的视觉记忆巩固。
如需原文及补充材料请添加思影科技微信:siyingyxf或18983979082获取,如对思影课程及服务感兴趣也可加此微信号咨询。另思影提供免费文献下载服务,如需要也可添加此微信号入群,原文也会在群里发布,如果我们的解读对您的研究有帮助,请给个转发支持以及右下角点击一下在看,是对思影科技的支持,感谢!

微信扫码或者长按选择识别关注思影非常感谢转发支持与推荐
欢迎浏览思影的数据处理业务及课程介绍。(请直接点击下文文字即可浏览思影科技所有的课程,欢迎添加微信号siyingyxf或18983979082进行咨询,所有课程均开放报名,报名后我们会第一时间联系,并保留已报名学员名额):
脑电及红外、眼动:
南京:
第二十三届脑电数据处理入门班(南京,4.23-27)
北京:
第二十五届脑电数据处理入门班(北京,5.16-20)
上海:
第三届脑电机器学习数据处理班(Matlab版,上海,5.15-20)
第三十六届脑电数据处理中级班(上海,5.28-6.1)
重庆:
第二十二届近红外脑功能数据处理班(重庆,5.24-29)
核磁:
北京:
第五十九届磁共振脑影像基础班(北京,4.14-19)
第二十九届磁共振脑网络数据处理班(北京,4.22-27)
第二十五届DTI班(北京,5.6-11)
第十一届磁共振ASL班(北京,5.12-15)
第二十二届脑影像机器学习班(北京,5.28-6.2)
第二十届磁共振脑影像结构班(北京,6.4-9)
重庆:
第十九届磁共振脑影像结构班(重庆,4.13-18)
第六十届磁共振脑影像基础班(重庆,4.21-26)
第五届影像组学班(重庆,5.19-23)
上海:
第十二届任务态功能磁共振数据处理班(上海,4.21-25)
第六十一届磁共振脑影像基础班(上海,5.7-12)
更新:第二十八届磁共振脑网络数据处理班(上海,5.22-27)
更新:第四届影像组学班(上海,6.2-6)
数据处理业务介绍:
思影科技功能磁共振(fMRI)数据处理业务
思影科技弥散加权成像(DWI/dMRI)数据处理
思影科技脑结构磁共振成像数据处理业务(T1)
思影科技啮齿类动物(大小鼠)神经影像数据处理业务
思影数据处理业务三:ASL数据处理
思影科技脑影像机器学习数据处理业务介绍
思影科技微生物菌群分析业务
思影科技EEG/ERP数据处理业务
思影科技近红外脑功能数据处理服务
思影科技脑电机器学习数据处理业务
思影数据处理服务六:脑磁图(MEG)数据处理
思影科技眼动数据处理服务
招聘及产品:
思影科技招聘数据处理工程师 (上海,北京,南京)
BIOSEMI脑电系统介绍
目镜式功能磁共振刺激系统介绍