生物电磁学为人类神经科学贡献了一些最常用的技术,如脑磁图(magnetoencephalography, MEG),脑电图(electroencephalography,EEG),经颅磁刺激(transcranial magnetic stimulation, TMS)和经颅电刺激(transcranial electric stimulation, TES)。它们在技术设计和实际用途方面的巨大差异给人的印象是,这些是完全不同的技术。在这里,我们回顾,讨论和说明亥姆霍兹互惠性(Helmholtz reciprocity)的基本原则,该原则为所有四种技术提供了共同点。我们表明,在亥姆霍兹于1853年发现互惠性150多年后,互易性对于理解这四种经典工具在神经科学中的优势和局限性非常重要。我们通过解释亥姆霍兹互惠性的概念来构建这个案例,为所有四种方法提供这一原理的方法论解释,最后,通过临床研究说明它在实际中的应用。本文发表在The Neuroscientist杂志。(可添加微信号siyingyxf或18983979082获取原文,另思影提供免费文献下载服务,如需要也可添加此微信号入群,原文也会在群里发布)。
温故而知新,建议结合以下脑刺激相关解读阅读(直接点击,即可浏览,加微信号siyingyxf或18983979082获取原文及补充材料):
使用自适应闭环刺激打破与人脑互动的界限
经颅交流电刺激(tACS):使大脑节律同步以提高认知能力
经颅交流电刺激(tACS)的机制和方案
神经刺激对脑功能和认知的状态依赖效应
AJP:rTMS急性神经可塑性对抑郁症治疗结果的预测价值
AJP:斯坦福加速智能神经调控疗法治疗难治性抑郁症
斯坦福神经调控疗法
迈向阿尔茨海默病的无创脑刺激2.0时代
经颅电刺激促进睡眠振荡及其功能耦合增强轻度认知障碍患者的记忆巩固
Trends in Neurosciences:通过脑振荡的夹带调节人类记忆
多疗程40Hz tACS对阿尔茨海默病患者海马灌注的影响
经颅磁刺激治疗老年抑郁症
相位相关TMS对脑电皮层运动网络的影响
BiologicalPsychiatry:解析电休克疗法的网络机制
前庭电刺激(GVS)的数据分析及在神经康复中的应用
通过脑电图/脑磁图观察到的大脑活动来指导经颅脑刺激
TMS-EEG的临床应用及展望
阿尔茨海默病的神经振荡和脑刺激
Trendsin Neurosciences:基于信息的无创经颅脑刺激方法
从组水平到个体水平的精神分裂症谱系障碍无创脑刺激
PNAS:大脑区域间耦合的增加和减少会相应增加和减少人类大脑中的振荡活动 Theta-burst经颅磁刺激治疗创伤后应激障碍
亚属连接预测经颅磁刺激位点抗抑郁疗效
成瘾和重度抑郁症的无创脑刺激治疗
TDCS刺激强度对健康受试者工作记忆的影响
交叉频率耦合在认知控制不同成分中的因果作用
睡眠、无创脑刺激和老化的大脑研究
Nature Medicine:经颅交流电刺激可以改善强迫症
经颅磁刺激与行为
经颅电刺激对生理和病理衰老过程中情景记忆的影响
TheNeuroscientist:整合TMS、EEG和MRI——研究大脑连接性
皮质成对关联刺激决策反应抑制:皮质-皮质间和皮质-皮质下网络
我们是如何感知行动的影响的?—关于中介感的任务态fMRI研究
使用刺激设备在神经回路调控层面对精神疾病进行治疗
AJP:基于环路神经调节的症状特异性治疗靶点
θ和α振荡在工作记忆控制中作用的因果证据
TMS-EEG研究:大脑反应为卒中后的运动恢复提供个体化数据
皮质运动兴奋性不受中央区mu节律相位的调节
TMS–EEG联合分析在人类大脑皮层连接组探索中的贡献
人类连接体的个体化扰动揭示了与认知相关的可复现的网络动态生物标记物
重复经颅磁刺激产生抗抑郁效果的基础:全脑功能连接与与局部兴奋度变化
实时EEG触发的TMS对抑郁症患者左背外侧前额叶皮层进行脑振荡同步刺激
经颅直流电刺激对双相情感障碍患者奖赏回路的影响
运动皮层同步对先兆亨廷顿病患者运动功能节律性
Nature子刊:卒中的可塑性调控:一种新的神经功能恢复模型
对PTSD和MDD共病患者的TMS临床治疗反应的脑网络机制的探索
创伤后应激障碍(PTSD)的功能连接神经生物标记
MDD患者rTMS治疗与亚属扣带回(SGC)亢进的关系
精神分裂症在感觉运动控制,皮层兴奋性中缺损的注意调控
AJP:经颅磁结合脑网络研究:精神分裂症的小脑-前额叶网络连接
经颅交流电刺激(tACS)有助于老年人工作记忆的恢复
深部经颅磁刺激促进肥胖症患者减肥
Biological Psychiatry: 经颅磁刺激前额皮层增强人类恐惧记忆的消退
JAMAPsychiatry:经颅直流电刺激背外侧前额叶减少特质焦虑对威胁刺激的反应
tACS结合EEG研究:创造力的神经机制
AJP:使用ASL灌注导向的经颅磁刺激治疗强迫症
NEJM:WavingHello to Noninvasive Deep-Brain Stimulation
BiologicalPsychiatry: 利用脑成像改善经颅磁刺激治
θ短阵快速脉冲刺激治疗青年抑郁症的神经机制
1. 引言
为了研究人脑,科学家通常依靠生物电磁学的非侵入性方法,如脑磁图(magnetoencephalography, MEG)和脑电图(electroencephalography,EEG)以及经颅脑刺激技术。MEG与EEG密切相关,两者都能够以毫秒级的高时间分辨率对神经元活动进行无创,多通道测量。因此,它们非常适合研究大脑动力学。先前的综述提供了对MEG和EEG及其应用的全面介绍和概述。同样,已经发布了MEG和EEG信号分析指南以及此类分析的结果,这里将不涵盖。相反,我们希望关注一个迄今为止受到较少关注的话题——即MEG / EEG与通过经颅电(transcranial electricstimulation, TES)或磁(transcranial magnetic stimulation,TMS)刺激进行神经刺激之间的理论和实践关系。 从理论上讲,这两套技术都通过亥姆霍兹互惠定理从根本上联系在一起,我们将在下面更详细地描述该定理。通过考虑这个定理,我们将看到MEG / EEG一方面和TMS / TES是同一枚硬币的不同方面,因为它们受相同的物理原理控制。实际上,作为临床或认知神经科学家手中的工具,这种密切的关系通过它们的互补作用变得清晰起来:MEG / EEG允许记录神经活动,而TMS / TES允许操纵神经活动。在各自的角色中,所有这些技术最终都基于相同的物理定律 - 麦克斯韦方程组。
在以下各节中,我们将从理论原理到实际含义,列出MEG / EEG和TMS / TES之间的密切关系。我们将从对这些方法的简短介绍开始,然后描述它们对正向和逆向建模的密切关系的重要性(参见方框1了解这些术语的定义),最后讨论它们在基本认知和临床应用中协同使用的实际例子。
方框1
亥姆霍兹互惠
MEG/ EEG和TMS / TES之间亲密关系的核心可追溯到亥姆霍兹的互惠定理。虽然它基于基本物理定律,并且对这些技术的实际使用具有重大影响,但基本思想相对简单。在这里,我们在TES和EEG的背景下介绍这个定理。考虑一个简单的TES场景,其中电流通过右侧(阳极红)和左侧(阴极蓝)颞叶脑区的两个电极贴片注入和放电。图1显示了大脑中电流强度和电流方向的计算分布,在三隔室(皮肤,颅骨,大脑)头部模型中计算。重要的是,相同的分布具有第二个同样有效的解释,因为它表示具有这种特定电极配置(仅两个电极)的EEG记录的灵敏度曲线(称为主场[leadfield])。更准确地说,某个体素中的向量(由位置,方向和幅度/长度描述)说明了如果单位强度为1的假设神经元源朝向锥体的方向,将测量两个电极之间的电位差。对于任何方向的电流,可以计算到该矢量场上的投影以产生测量的电位。例如,垂直于锥体方向的电流定向不会在两个电极之间产生可测量的差异电位(投影等于零)。
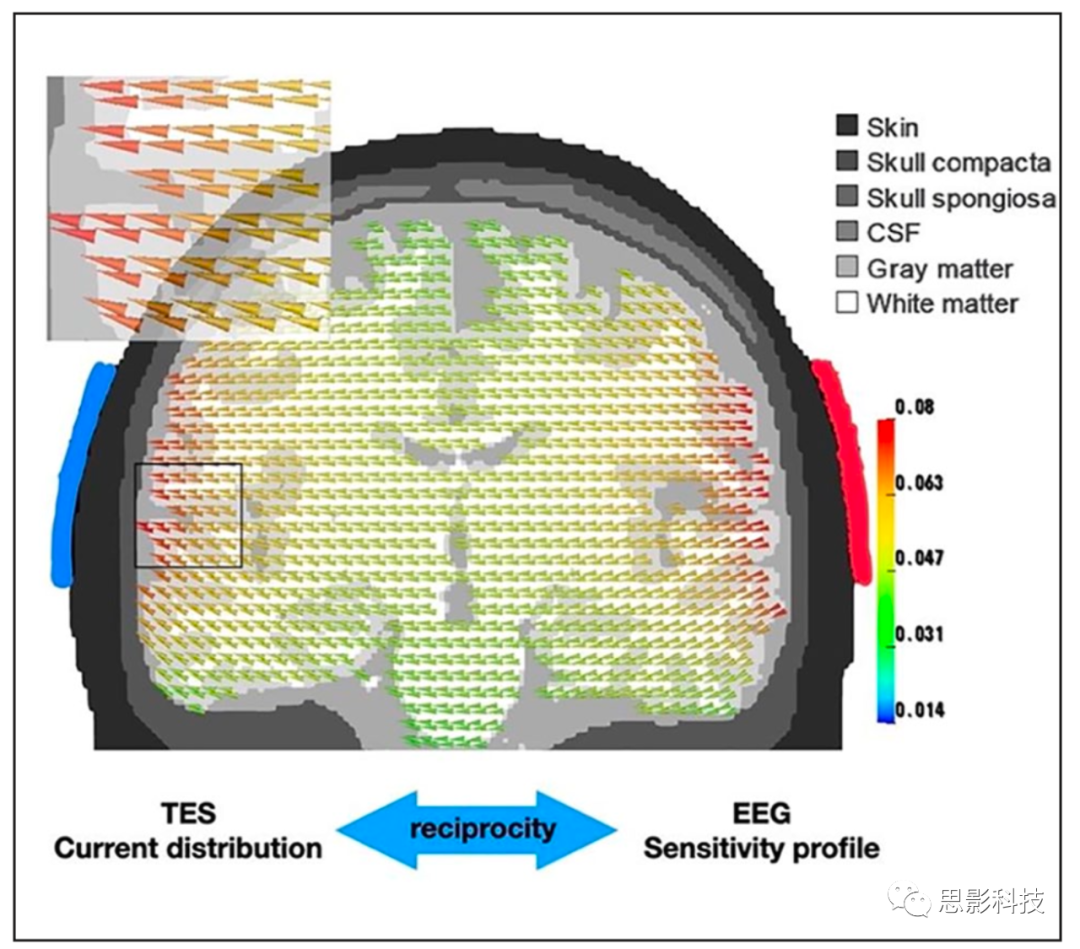
图 1. 亥姆霍兹互惠定理的图示。同一矢量场一方面表示由两个经颅电刺激(transcranialelectrical stimulation, TES)电极(红色片:阳极,蓝色片:阴极)诱导的电流分布,另一方面,这两个电极对任何给定位置的电流源的灵敏度曲线。
因此,相比于靠近tDCS片(红色)的皮质结构,皮质下区域(深绿色)中的神经源更难以通过经颅直流电刺激/经颅交流电刺激(transcranial direct currentstimulation/transcranial alternating current stimulation, tDCS / tACS)激发,并且更深结构中的神经发生器相互唤起电极之间较小的电位差异。虽然更深的结构只能被更强的电流激发,但除非使用复杂的干扰技术,否则这种刺激将同时激发更强的表面源。同样,MEG / EEG对皮质下脑区的神经活动不太敏感,与皮质源相比,这些源的定位不太准确。另一个重要的互惠涉及MEG和TMS:由于与头皮正交的源(即径向源)在头部外几乎没有可测量的磁场,这些源可以相互地不通过磁刺激被激发或抑制。
亥姆霍兹互惠的概念与正向和逆向问题的概念有关,这些概念与本文的其余部分同样相关。在EEG/MEG的背景下,前向问题是指在大脑中具有给定方向的特定位置的偶极子,估计EEG电极和/或MEG传感器在头部和/或头部外的位置的电位和/或磁场的问题。逆问题是指估计大脑中电流源分布的问题,该分布在头部或/和头部外部产生给定的电位或/和磁场模式。亥姆霍兹已经指出,EEG/MEG逆问题的解决方案并非唯一,也就是说,无限数量的电流分布可以导致相同的电位或/和磁场模式。因此,EEG/MEG源定位方法采用额外的约束来产生独特的解决方案。
2. MEG/EEG和TMS/TES
MEG / EEG传感器以毫秒级的时间分辨率静默(silently)和非侵入性地采样由大脑中的神经元活动引起的磁场或电势。记录的信号与底层神经元电流之间的直接关系不受中间过程(如神经血管耦合)的影响,从而导致大规模神经元活动信息的丰富动态表示。虽然MEG / EEG对神经元活动产生的信号进行非侵入性记录,但TMS / TES的目标是通过向大脑注入磁场或电流来控制神经元活动的调节。
将MEG / EEG与神经刺激技术相结合有几个优点。首先,它允许研究人员通过MEG / EEG提供的全脑覆盖、高时间、良好的空间分辨率来评估和监测神经刺激对神经活动的影响。其次,神经刺激设置可以针对特定目标进行优化,并调节特定的神经活动模式(如大脑振荡)以探测它们与认知过程的(因果)相关性。第三,神经刺激具有显著的转化相关性,特别是对于治疗神经和精神健康障碍。在这里,MEG / EEG和神经刺激可以结合起来,以帮助优化刺激方案,确定作用机制,并更有力地评估治疗效果。
MEG和EEG信号甚至可以在TMS / TES期间同时记录,但当前同时TMS / MEG除外。虽然EEG记录可以在相位TMS期间暂时中断,但可以防止EEG放大器饱和,此方面正在等待新一代MEG传感器(见框2)。虽然不如TMS强,但TES在EEG和MEG记录期间也会产生相当强的伪影,但现代EEG放大器和现代SQUID(superconductingquantum interference device,超导量子干涉器件)传感器可以容忍通常施加的电流(<4mA)。然而,从EEG和MEG信号中去除TES / TMS伪影并非易事,因为伪影的幅度受到许多有节律和非节律过程的调节,例如心跳,呼吸,头部运动和电极阻抗的变化。
方框2
光泵磁强计(Optically Pumped Magnetometers, OPM):新型脑磁图(Magnetoencephalography, MEG)技术
光泵磁强计:下一代功能神经影像工具
最近开发的OPM是传统基于SQUID的MEG系统的有前途的替代品。OPM不依赖于超导性来运行,因此不需要液氦。因此,基于OPM的MEG系统维护起来更容易,成本更低。典型的设计使用光电二极管来测量激光穿过充满气体的玻璃小室(gas-filled glasscell)后的强度。光传输对光电二极管可以检测到的环境磁场的变化很敏感。近年来,OPM的灵敏度显著提高,现在与SQUID传感器的灵敏度相似。OPM传感器的尺寸也可以显著减小,因此现在可以集成到移动系统中——类似于EEG(见图2)。重要的是,OPM受益于传感器和大脑之间距离的缩短,导致当前OPM系统(少于50个传感器)与具有100多个传感器的SQUID系统的性能相当。尽管OPM具有明显的优势,但它们受到相对较低的信号带宽(约150 Hz,而SQUID的带宽约为几kHz)和一些技术挑战(例如相邻传感器之间的串扰)的限制,在高密度全头皮OPM系统中需要考虑上述挑战。

图 2. 50通道光泵磁力计(optically pumped magnetometer, OPM)系统示例
EEG / MEG-TES研究的另一个重要考虑因素是刺激参数的优化,包括TES电极位置。通过使用基于真实体积导体模型的计算模型,可以改善特定目标区域或目标网络的刺激,理想情况下,计算模型来自个体解剖学磁共振成像(magnetic resonanceimaging, MRI),计算机断层扫描(computedtomography, CT)等和/或基于EEG / MEG,功能MRI(functional MRI,fMRI),正电子发射断层扫描(positron emissiontomography, PET),近红外光谱(near infraredspectroscopy, NIRS)等的个体功能测量(见图3)。现代多通道TES系统提供了进一步的自由度来控制感应电流的路径,焦点和方向,从而以最佳方式刺激目标区域。这是一个有前途和积极的研究领域,将时空详细的电生理记录与多功能神经刺激技术相结合,产生令人兴奋的前景。
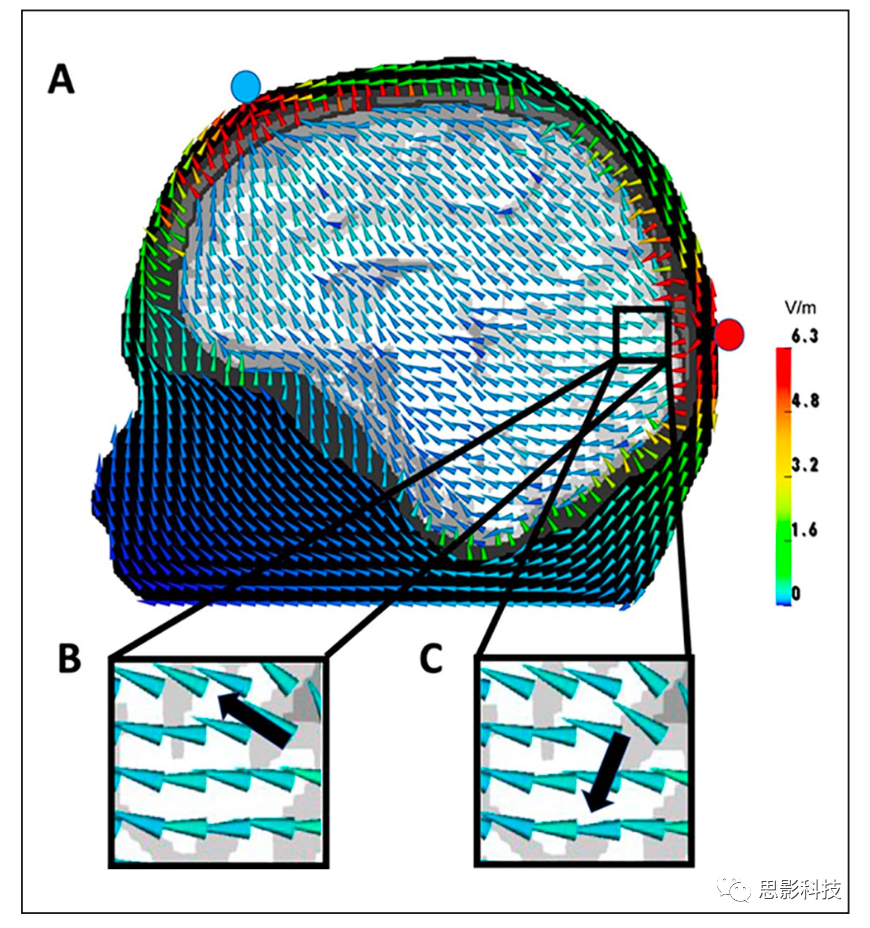
图 3.(A) 枕阳极(红色圆圈)和额阴极(蓝色圆圈)的经颅电刺激(Transcranialelectrical stimulation, TES)电场,在六室(皮肤、颅骨、颅骨致密体[compacta]、颅骨海绵体[skull spongiosa]、脑脊液、灰质和各向异性白质)有限元模型中计算。大小归一化锥体用于表示矢量方向,并且它们被颜色编码以呈现矢量场振幅。根据亥姆霍兹互惠性,偶极子源(黑色箭头)的两个电极之间的脑电图(electroencephalography,EEG)电位差可以通过偶极矩和电场矢量在同一位置的点积来确定,因此场景(B)将产生最大和(C)零电位差。
虽然目前还不可能同时使用TMS-MEG,但TMS已经通过利用更持久的刺激效应(即后效应)与MEG结合使用。在这些类型的研究中,TMS通过兴奋性或抑制性TMS方案刺激目标区域,该方案应导致神经活动的持续变化,可持续数小时。例如,行为和神经效应可以通过比较刺激前后的两个MEG疗程来评估,这种方法可用于任何神经刺激技术。
在下一节中,我们将从方法论的角度讨论MEG / EEG和TMS / TES之间错综复杂的关系。
3. EEG和MEG的逆问题:源分析(Source Analysis)
在过去的几十年中,EEG和MEG源分析已成为重建具有最高时间和适当空间分辨率的神经元网络的突出技术。所谓的EEG和MEG逆问题旨在重建sources——主要是在大脑灰质中——这是头部表面测量的电位和场分布的基础。已经证明在没有对源进行任何额外先验的情况下,逆问题的解决方案不是唯一的 ——也就是说,容积导体内部的无限数量的源分布可以导致容积导体外部的一个相同的电势和/或磁场模式。因此,EEG和MEG源定位方法对基础的源分布采用额外的约束,以产生独特的逆解。这些反演方法的分类可以分为焦点电流建模、波束成形和分布式电流建模。在焦点电流建模中,少量偶极源(dipolar sources)被拟合到测量的EEG和/或MEG数据上。下面介绍的第一个应用示例了癫痫患者在平均EEG和MEG尖峰活动开始时的这种局灶性电流建模结果(图6中的目标黑锥体),下面将更详细地讨论。当源数量未知或电流分布可能具有较大的空间范围时,焦点电流模型不合适。空间滤波或波束成形(beamforming)方法,例如在第二个示例中用于估计吞咽行为期间的神经源(见图7),在单个位置或小区域优化估计,同时抑制来自其他区域的串扰。在分布式电流模型中,电流由大量具有固定位置和可能方向的聚焦基本源离散化。例如,这种方法已应用于以下第三个示例(见图8)中情绪面部处理的源重建中,称为电流密度重建。然后,结合有关解的全局属性的先验信息,例如最小范数估计(minimum norm estimation, MNE)。应该提到的是,分层贝叶斯建模形成了几种反转方法的超类(superclass)。重要的是,所有逆方法都可用于识别激活神经元群体的位置和方向,这些群体可以被定义为神经刺激的靶点。
4. 靶向多通道脑刺激的逆问题
诸如TES之类的脑刺激技术允许调节(即激活或抑制)大脑网络内的神经活动和功能连接。TES包括经颅直流(transcranial direct current stimulation,tDCS)或交流电刺激(transcranialalternating current stimulation, tACS),是一种非侵入性方法,通过膜极化的变化来操纵大脑兴奋性,并根据刺激的极性,持续时间和强度在大脑中诱导持久(几分钟甚至数小时)的变化。在经典的tDCS中,通过至少一个电极(阳极)将小电流(例如,0.5-4 mA)施加到人头上,并在另一个电极(阴极)处除去。图3A显示了这种经典tDCS排布的仿真。这种电流可以增加或减少感兴趣区域的皮质兴奋性,这取决于其极性。传统的双极性tDCS排布假设所谓的“阳极刺激”增加了下层皮质区域(图3A,枕部区域)内的兴奋性。然而,最近的研究表明,这种设置中的皮质电流模式相当广泛,通常在非目标大脑区域中具有最大刺激,并且靶点位置和靶点方向均与最佳刺激有关。这里的靶向是指神经刺激靶向的大脑区域中神经元的主要空间取向。沿该主要方向注入tDCS电流对于最大化刺激效果非常重要。例如,在皮质区域,锥体神经元通常垂直于皮质表面方向。在皮质下大脑结构(如海马体和杏仁核)中,神经元的首选方向通常不存在,使得靶点方向的概念变得毫无意义。例如,Mills及其同事在初级运动皮层的手部表示(hand representation)上使用不同的TMS线圈方向显示了对靶点位置和方向的敏感性,同时记录了对侧手部肌肉的运动诱发电位(motor-evokedpotentials, MEPs)。他们的结果表明,电流的方向是至关重要的,也就是说,不仅位置重要,而且相对于大脑的方向以及由此产生的电流方向也很重要,线圈在大约50°处对准矢状面(parasagittal plane)的MEP响应最大,产生最大的感应电流,以大约直角向前流动到中央沟。在使用TMS和MEP与tDCS相结合的类似实验中,Rawji等人表明,电流的方向对于tDCS后效应也很重要。因此,如图3A所示的tDCS刺激配置将在大脑内部产生一个电场,该电场方向主要平行于靶点(黑色箭头),其位置和方向如场景(B)所示。因此,这种特定的电极排布将对这个特定的平行定向靶点产生强烈的兴奋作用。然而,对于具有几乎相同位置但现在与电场正交方向的靶点,如图3C所示,这种电极配置的刺激几乎没有影响(即,电场矢量和目标力矩之间的点积几乎为零)。因此,适当的瞄准意味着:(1)注入的电流不仅在感兴趣区域处最大(强度),(2)在其他区域(焦点)最小,而且还(3)主要定向平行(激励)或反平行(抑制)到靶点方向(方向性)。由于这种靶向的复杂性和多通道tDCS(multichannel tDCS,mc-tDCS)硬件的复杂性,计算机优化方法,即解决mc-tDCS逆问题的新方法已成为靶向脑刺激的重要工具。最近,已经推导出了这种优化方法的统一,并且已经显示出焦点强度的权衡,即优化方法可以在焦点强度尺度上进行排序,焦点方法在尺度的一侧,基于强度的优化方法在另一侧,说明靶点的聚焦和最大刺激强度不能用同一种方法实现。最后,关于刺激强度,Agboada等人表明,它与刺激结果非线性相关,这可能与细胞内钙的增加有关:较大的刺激强度增加钙水平以诱导长时增强(long-termpotentiation, LTP)样可塑性,而较低的刺激强度导致长时抑制(long-termdepression, LTD)样可塑性。
请注意,简单情况下,平行于靶点方向的注入电流会导致兴奋,而反平行导致仅对tDCS产生抑制。其他刺激方法和方案将涉及其他作用机制。例如,tACS采用具有快速交流方向的电刺激。rTMS 快速连续地应用单个脉冲。这两种方法都被认为会导致频率特异性共振效应,可用于改变神经元节律的振幅。
5. 亥姆霍兹互惠性、生物电磁前向问题和头部建模
为了提高性能,将上述逆向和优化方法与现代前向建模方法相结合至关重要。EEG和TES以及MEG和TMS前向问题通过亥姆霍兹的互惠原则密切相关,这意味着其中一个精度的任何改进也将相互导致另一个的改进。对于TES和EEG的互惠性,这在图3中可视化,TMS和MEG的互惠性在图4中可视化。更明确地,Wagner和其他人能够通过分析数值结果,与简化的容积导体中的分析推导前向电位进行比较,估计计算复杂性,甚至推导出一个代数证明,甚至对现实的头部容积导体模型也有效,来证明亥姆霍兹互惠关系提供了TES和EEG前向问题之间的直接联系。对于磁前向问题,Nolte和Vallaghe等人已经解决了这种基于互惠的关系。因此,在下文中,我们将把源分析的生物电磁前向问题与非侵入性脑刺激的仿真结合起来。与EEG逆问题相反,EEG前向问题解决方案的存在性和唯一性已被证明。根据现有的输入数据,提出了不同的前向建模方法,从EEG中用于简化的多层球头模型和MEG中的重叠球体的准分析解,到MEG中一个脑室(compartment)的真实形状头部模型或三个各向同性脑室(3CI:皮肤,颅骨,大脑),用于EEG中与边界元法(boundary elementmethod, BEM)或有限元法(finite elementmethod, FEM)相结合。不同前向建模方法之间的比较不仅可以验证一种方法与另一种方法的比较,还可以确定模型误差和数值误差以及计算性能。尽管3CI头部模型在几何上单独准确地表示了颅骨和皮肤表面,因此与更简单的多层球体模型相比,已经减少了模型误差,但它们仍然基于相当粗糙的均匀化和头部容积传导的近似(即不同组织内的电导率)。首先,在标准3CI建模中,大多数情况下使用标准文献值作为电导率参数。然而,对于EEG和TES,众所周知,颅骨电导率在个体之间差异很大,可以从非侵入性神经生理学数据中估计。图5说明了准确的颅骨电导率建模的相关性。

图 4. 在四面体多室球有限元模型中计算的圆形线圈 (A) 和八字形线圈 (B) 的经颅磁刺激(Transcranialmagnetic stimulation, TMS)诱导的电流密度矢量场,通过该模型在切割平面上可视化。根据亥姆霍兹互惠性,在(圆形)磁力计线圈(C)和的(八字形)切向梯度计(D)偶极子源(黑色箭头)的磁脑图(magnetoencephalography,MEG)磁通量直接遵循容积导体中相同位置的偶极矩和场矢量之间的点积。
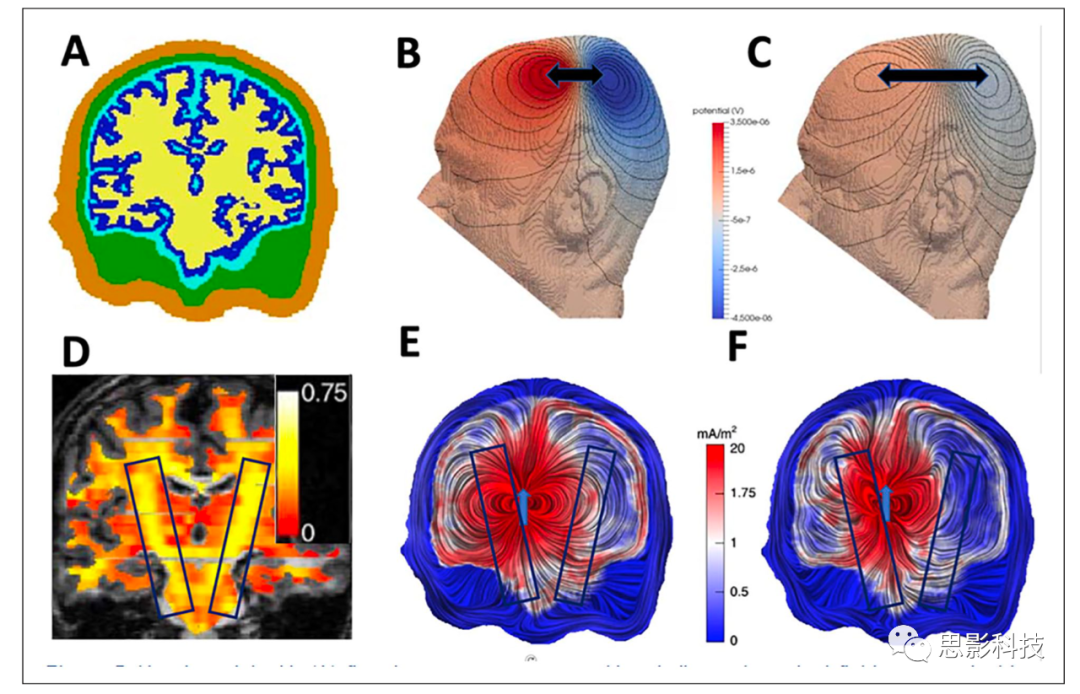
图 5. 头部模型具有(A)五个组织隔室:皮肤,颅骨,脑脊液,灰质和白质。(B、C)躯体感觉皮层中主要面向切向的源的等电位线,其中(B)中的基础模型的颅骨电导率比(C)中的高10倍。与(C)相比,(B)中的电位峰值和谷值之间的较小距离由黑色箭头表示。(D)基于弥散张量磁共振成像(magnetic resonance imaging, MRI)的白质室各向异性分数。头部模型中丘脑偶极子源的容积电流,具有(E)各向同性和(F)1:10白质电导率各向异性。
由皮肤、颅骨、脑脊液(cerebrospinal fluid, CSF)、灰质和各向异性白质 (D) 构建的 5 室头模型(A)的躯体感觉皮层中的切向源将在模型表面上生成 EEG 等电位线,如(B)和(C)所示。B和C之间的唯一区别是,与(C)相比,(B)的颅骨电导率建模高出十倍,导致(B)中的表面电位要高得多,并且(B)中的正电位波峰和负电位波谷之间的距离更小,如黑色箭头所示。在EEG逆问题的背景下,忽略单个颅骨电导率的方差将主要导致深度定位误差(因为波峰和波谷之间的距离随着源深度的增加而增加)。除了颅骨电导率建模外,准确的CSF电导率建模的重要性在仿真和实验中得到了证明。例如,图5E和F说明了高CSF电导率对丘脑源产生的容积电流的影响,导致CSF室中的振幅容积电流和电流通道更高,从而降低EEG表面电位幅度。最后,区分灰质和白质电导率并模拟白质电导率各向异性可以进一步提高生物电磁前向建模的准确性。在这里,也如图3所示,术语各向异性是指材料(这里的白质)的性质,以允许与各向同性相反的不同方向上的变化,即平行于白质束的电导率高于两个垂直方向。为了说明白质电导率各向异性容积导体效应,图5的下面一行显示了具有各向同性的丘脑偶极子源(E)的体积电流与1:10各向异性(白质束垂直:平行)白质室(F)的容积电流,在穿过模型的冠状切面上可视化。因此,各向异性白质电导率导致返回电流平行于白质纤维束流动,这可以通过高度各向异性的锥体束对容积电流的较大影响来具体观察到,如图5D-F中的黑框所示。还要注意(D)中弥散张量MRI对锥体束的相应高各向异性分数。还可以得出结论,源越深,它被各向异性白质组织包围的次数越多,各向异性对电场结果的影响就越大。
图3显示了六室各向异性(six-compartment anisotropic, 6CA:头皮,颅骨致密体[skull compacta],颅骨海绵[skull spongiosa],CSF,灰质和各向异性白质)FEM头模型中阳极(枕电极)和阴极(额电极)的模拟TES电场(electric field, EF)。该图显示了重要的TES效应:首先,在头皮隔室中主要发现了切向EF方向。其次,EF方向在低导颅骨隔室中主要是径向的。第三,高CSF电导率和各向异性白质电导率对颅内隔室中的EF方向有相当大的影响。最后,EF振幅随着与刺激电极距离的增加主要呈现(但不仅如此)下降趋势。
可以使用基于T1加权(T1-weighted-,T1w-),T2w-MRI和扩散加权MRI的(半)自动处理流程构建逼真的个性化头部模型。这允许使用现实的个性化头部模型来测量通常用于认知和临床神经科学研究的样本量,并具有合理的时间投入和计算资源。逼真的个性化头部模型的构建和TMS/TES刺激的仿真可以在开源工具箱中找到,例如SimNIBS和ROAST。更具体的开源工具箱是关于生物电磁前向问题的主题,如DUNEuro,OpenMEEG和BEM-FMM。
在下一节中,我们将介绍四项研究,这些研究结合了MEG/EEG和TMS/TES,并对其协同使用的广泛范围进行了采样。
如您对脑电等数据处理感兴趣,请浏览思影以下链接(直接点击即可浏览),感谢转发支持。(可添加微信号siyingyxf或18983979082咨询):
重庆:
第四届脑电机器学习数据处理班(Matlab版本,重庆,9.24-29)
第二十七届脑电数据处理入门班(重庆,10.28-11.2)
北京:
第三十九届脑电数据处理中级班(北京,10.11-16)
更新:第十三届眼动数据处理班(北京,10.26-31)
上海:
第二十五届近红外脑功能数据处理班(上海,10.17-22)
第三十六届脑电数据处理中级班(上海,11.13-18)
南京:
第五届脑电机器学习数据处理班(Matlab版本,南京,11.3-8)
数据处理业务介绍:
思影科技EEG/ERP数据处理业务
思影科技近红外脑功能数据处理服务
思影科技脑电机器学习数据处理业务
思影数据处理服务六:脑磁图(MEG)数据处理
思影科技眼动数据处理服务
招聘及产品:
思影科技招聘数据处理工程师 (上海,北京,南京)
BIOSEMI脑电系统介绍
目镜式功能磁共振刺激系统介绍
6. 神经刺激与MEG/EEG联合的应用
在过去十年中,将高密度EEG/MEG神经影像学与靶向TMS/TES脑刺激相结合的研究数量呈指数级增长。因此,认知和临床神经科学中的应用范围已大大扩展。选取以下四个例子来概述方法、方法组合和应用的范围。这一具体选择部分反映了作者研究兴趣的临床方向,绝不代表对该领域众多优秀研究的任何优越性。
功能神经影像学的进步不断增加我们对导致脑部疾病的神经回路病理改变的理解。这种先进的知识导致对大脑刺激方法的兴趣增加,以调节已识别的异常神经元活动模式。反过来,脑刺激的临床治疗效果也可以告诉我们潜在的疾病机制,并允许我们评估分布式网络中受刺激的大脑区域的因果关系,而不仅仅是纯粹的相关性关联。
6.1 联合tDCS/MEG/EEG在药物核心局灶性癫痫潜在治疗策略中的应用
例如,EEG和MEG源分析和连通性研究可以从根本上有助于理解癫痫发生(epileptogenesis),癫痫发作产生(seizure generation)和癫痫发作传播(seizure propagation)背后的病理机制。因此,它可能为新的治疗方案铺平道路,包括非侵入性(例如,TES)和侵入性形式,如癫痫手术。虽然对于某些患者,必须假设非局灶性的病理机制,但其他人具有相当局灶性的致痫网络,在局灶性皮质切除术后有合理的机会变得无癫痫发作。
通过优化的多通道TES进行个体靶向可以改善治疗效果并减少负面副作用。图6举例说明了局灶性癫痫的个体化治疗程序:使用平均EEG/MEG尖峰活动开始的反向(局灶电流)源建模来定位药物抵抗性局灶性癫痫患者的致痫区(顶行的黑色圆锥)。针对焦点-强度连续体(focality-intensity continuum)的更焦点侧的靶点位置和方向的tDCS优化导致注入和放电电流的分布(如顶行所示),并在大脑中引起局灶性但低强度的电流密度分布(如底行所示)。由于这种局灶性刺激减少了副作用,因此可以更频繁地在更长的时间内应用。针对目标区域最大强度的tDCS优化将增加效应大小,但也会导致周围区域更强的共同激活,从而产生更多副作用。在该示例中,高密度EEG和MEG的组合提供了出色的靶标信息,作为高度局灶性多通道刺激靶向的先决条件(另见图10),从而说明了个体化tDCS脑刺激如何改善治疗结果。
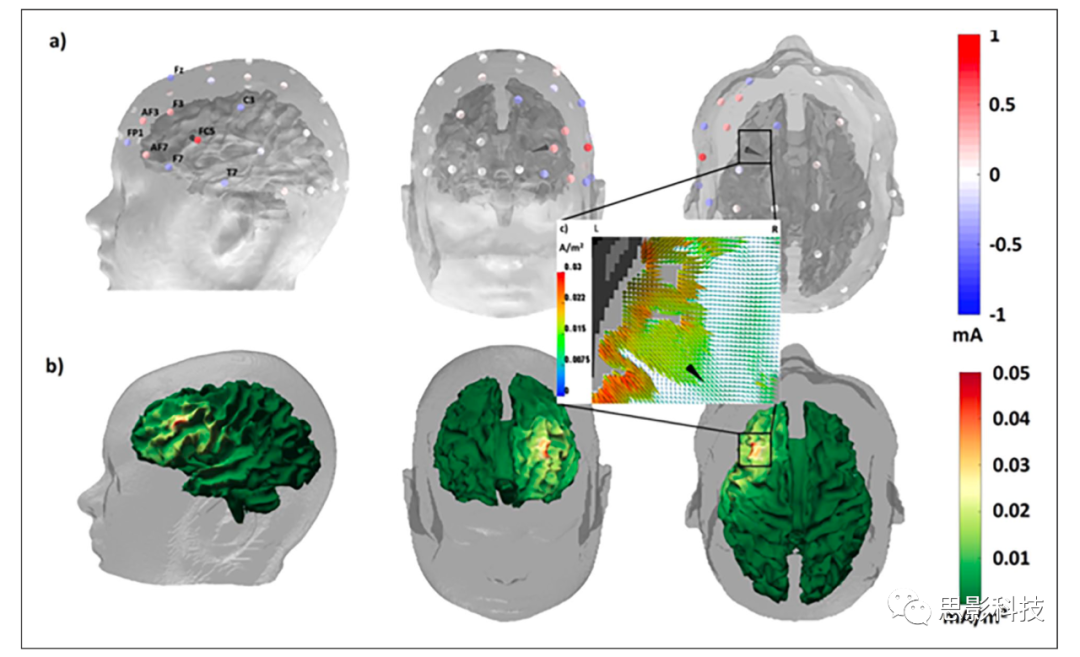
图 6. 单被试的靶向多通道经颅直流电刺激(multichannel transcranial direct current stimulation, mc-tDCS)作为抑制性刺激,用于因Broca区域附近的局灶性皮质发育不良而导致的药剂抵抗性癫痫患者。(a)乘法器电流定向方法(Alternating direction methodof multipliers, ADMM)优化的mc-tDCS蒙太奇,用于刺激致痫区,通过脑电图(electroencephalography, EEG)和脑磁图(magnetoencephalography, MEG)尖峰活动的局灶源建模重建(黑锥)。电极由−1至+1 mA的优化电流着色。注入电流的总和等于2 mA,满足安全约束。优化的mc-tDCS电流密度分布在(b)皮质表面上,同时在(c)目标区域的缩放轴向磁共振成像(magnetic resonance imaging,MRI)视图上可视化。患者的脑表面颜色表示以mA / m2为单位测量的电流密度的分布。
6.2 联合tDCS/MEG在检测脑卒中吞咽困难潜在新治疗策略中的应用
吞咽依赖于高度复杂的感觉运动功能,需要广泛分布的神经网络活动。因此,吞咽紊乱(口咽吞咽困难oropharyngeal dysphagia,OD)是经常主诉后的表现也就不足为奇了。OD 的自发恢复与未受影响半球的吞咽相关区域的代偿性变化有关,皮质兴奋性增强,运动表现扩大,作为皮质可塑性的替代物。
在一项随机对照试验中,Suntrup-Krueger及其同事发现,与假刺激相比,对未受影响的运动皮质吞咽网络的兴奋性tDCS刺激导致吞咽功能的更大改善。事实上,在干预 4 天后,真实的(verum)tDCS 在原发性和继发性临床结局方面比假刺激显著改善。在一组患者亚组中进行的治疗前后MEG测量显示,由于标准治疗,两组在alpha和beta波段中均显示事件相关去同步化(event-related desynchronization, ERD)增加(图7,上图),但verum组仅显示beta波段的附加效应(图7,底部)。因此,通过兴奋性tDCS促进吞咽网络活动的重组加速了急性中风后吞咽困难的康复。
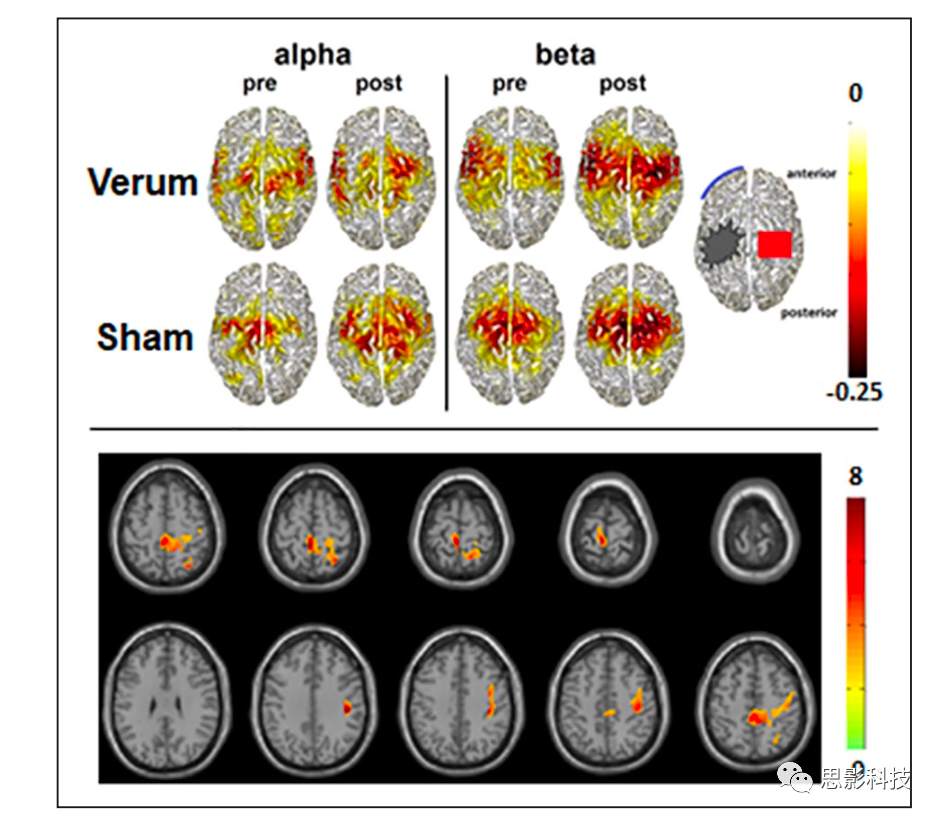
图 7. 经颅直流刺激(transcranial direct current stimulation, tDCS)真假刺激组的 alpha 和beta 频率范围内,图中显示与吞咽相关的激活在 alpha 和beta频率范围内组平均的源分布。颜色条表示相对于静息态的功率变化。负值表示与事件相关的振荡活动不同步。
底部:经颅直流电真刺激后,beta频率范围内与吞咽相关的事件相关去同步化显著增加的区域(p < 0.05)。
这个例子表明,即使是非个体化的大脑刺激也可以调节高度自动化和复杂的大脑功能,如吞咽,从而在临床实践中保持标准化使用的前景。
6.3 tDCS/MEG联合用于检测潜在新型脑刺激靶点治疗情绪和焦虑症
腹内侧前额叶皮层(ventromedial prefrontal cortex, vmPFC)是被确定为情绪和焦虑障碍的患者最广泛报道的异常结构之一。在两项独立的fMRI和MEG研究中,Junghofer及其同事测试了带有头法外参考(extracephalic reference)的新型tDCS蒙太奇对优化的vmPFC刺激的影响(见图8顶部),并表明健康参与者中,与不愉快的情绪场景相比,兴奋性相对于抑制性的刺激放大了愉快情绪场景的处理。在一项后续研究中,Winker等人可以将这些发现复制并推广到情绪面部处理中,因为兴奋性与抑制性vmPFC-tDCS导致与恐惧面孔相比,快乐的处理增强,这与模糊面部表情的幸福感评级增强一致(见图8底部)。由于vmPFC的激活似乎增强了对厌恶刺激的诱人性,因此兴奋性vmPFC-tDCS可能会改善远离愉快信息靠近不愉快信息的偏见,这在患有情绪障碍的患者中通常报告。tDCS和MEG的结合还可以揭示一些关于vmPFC在焦虑中的潜在因果作用的新见解,因为抑制性vmPFC刺激诱导了恐惧泛化的“焦虑样”感知和神经模式。这个例子显示了神经刺激与MEG相结合可以测试定义的目标区域对神经或精神疾病中可能受到干扰的认知和情感过程的假定因果作用。关于亥姆霍兹互惠的另一个方面,这个例子还说明了,对于特殊靶点,头外tDCS参考如何规避所谓的“电参考问题(electric reference problem)”,这对于脑电刺激(tDCS)和脑信号的电记录(EEG)来说也是相互固有的。

图 8. 使用头外参考对腹内侧前额叶皮层(ventromedial prefrontal cortex, vmPFC)进行兴奋性(阳极)重复经颅直流电刺激(transcranial direct current stimulation, tDCS),与右半球视觉流中的恐惧面孔相比,导致相对增强的快乐处理,而抑制性刺激导致相反的模式。因此,兴奋性vmPFC刺激增强了对情绪模糊(变形)面部表情的评估。
6.4 同时应用TMS/EEG证明精神分裂症丘脑皮质回路的固有功能障碍
精神分裂症患者通常在休息和各种认知任务期间表现出诱发gamma波段活动和gamma同步性缺陷。通过利用TMS /高密度EEG方案的组合,Ferrarelli和同事旨在排除动机,注意力或认知能力受损的潜在共同影响。事实上,精神分裂症患者在TMS后的前100毫秒内在刺激的额中区域显示出异常的gamma振荡(见图9左),其振幅和同步性显著降低(图9中间)。此外,反向EEG源建模显示,患者的TMS诱发的大脑激活不会从受刺激的大脑区域传播。由于事件相关的EEG对直接皮质TMS的反应不受动机、注意力或认知能力的影响,也不通过外周传入通路传递,这些发现说明了精神分裂症患者丘脑皮质回路的固有功能障碍。这个例子说明了神经刺激和MEG / EEG的组合如何允许定向排除潜在的协变量,这在许多情况下使用其他方法(例如相关方法)要困难得多甚至不可能。
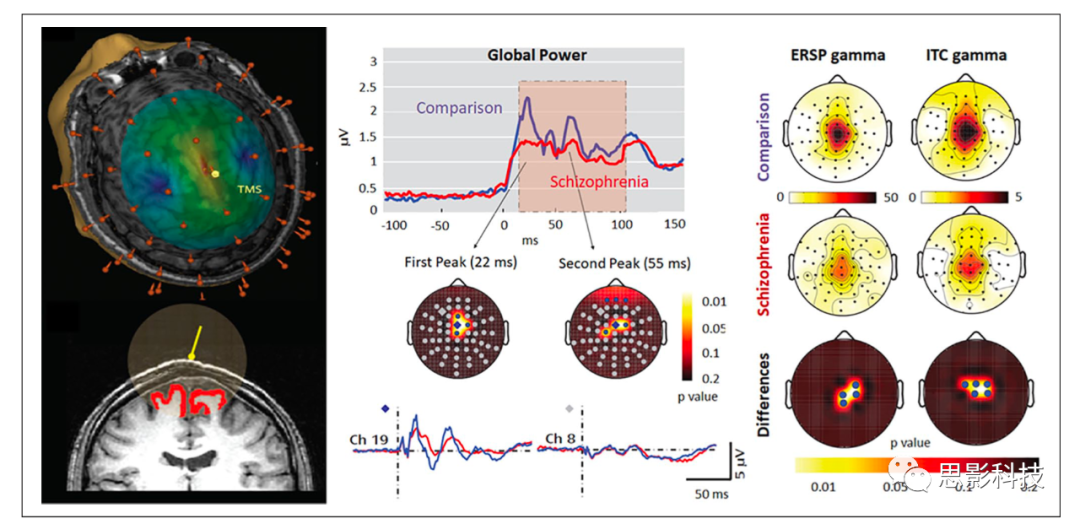
图 9. 左图:皮质表面经颅磁刺激(transcranial magnetic stimulation, TMS)产生的电场强度估计值,以及TMS影响灰质体积的估计值。中心:患者的TMS诱发振荡活动中,全脑场功率降低的时间和位置。右图:精神分裂症患者事件相关谱扰动(event-related spectral perturbation, ERSP)减少和试验间相干性值的拓扑图。
7. 讨论与结论
上面的例子给人的印象是TMS/TES与MEG/EEG的组合如何产生协同效应。他们还说明了MEG / EEG如何结合不同的脑刺激方法,例如,用于测试潜在的新治疗策略或发现/证明病理神经机制。然而,尽管靶向脑刺激的使用越来越成功,但关于不同脑刺激方法的作用机制,关于它们对刺激参数(如持续时间,重复,强度,频率和方向)的依赖性以及关于生理、心理状态和特征调节刺激效果的知识仍然相当稀缺。
在这里,我们证明了由于亥姆霍兹的互惠性,EEG和TES以及MEG和TMS在方法论上彼此密切相关,电和磁模式是互补的。例如,MEG对朝向颅内表面(桡骨)的神经源几乎无法探测,并且这些源也不能受到TMS的刺激,而EEG对径向源特别敏感。虽然对于径向靶点标准4×1 TES蒙太奇是聚焦刺激性的,因此处于焦点强度尺度的焦点侧,但靶点和阴极远处的阳极的第二个标准最大化了靶点强度,因此处于尺度的强度侧。MEG对切向源具有更高的灵敏度,这也可以通过TMS有效刺激。因此,MEG和EEG以及tDCS和TMS的互补灵敏度特点激发了电和磁模式的组合。
虽然我们在这里主要关注互惠问题,但应该指出的是,用于治疗目的的脑刺激的长期影响可能不仅与靶向大脑区域的直接调节有关,而且还可能由更一般的机制引起,例如更远区域的调节以及由神经递质和基因表达的变化介导的影响。
展望未来,我们预计硬件开发和改进的靶向方法将提高神经刺激的有效性,因为科学家继续努力更好地控制和理解刺激效应。现在已经确定刺激效果的建模(理想情况下考虑个体解剖结构)很重要。然而,刺激效果取决于许多因素。图10列出目标感兴趣区域(左;例如,反向EEG / MEG建模),靶向过程(中心;例如,前向建模)和刺激装置(右)的先验信息的不同复杂程度或准确性。例如,多通道TES优化可以提高刺激的有效性,但前提是单个靶标的位置和方向是众所周知的。因此,在刺激靶点比聚焦靶点更具区域性或只能粗略重建的许多情况下,标准双贴片TES在靶区上方,阴极远离(甚至头外)是合理的,如果靶区具有显著的径向取向成分,则具有高强度。因此,刺激装置的选择和刺激靶向方法取决于靶点的可用先验信息。然而,在所有情况下,准确报告刺激参数(如持续时间、强度、线圈/电极位置和方向)对于提高再现性和促进荟萃分析非常重要。
总之,MEG / EEG和TMS / TES的互补使用具有巨大的潜力,不仅可以提高我们对大脑认知过程的理解,还可以开发治疗神经和精神疾病的新方法。

图 10. 先验靶点信息和刺激靶向/设备复杂性的相互契合的说明。如果靶点位置或靶点网络只是粗略已知的(例如,前额叶皮层的腹侧区域),则使用基本TES / TMS设备的标准靶向方法完全足够,而更高的复杂程度甚至可能产生不利影响。如果单个靶点位置和靶点方向定义非常明确(如上面的癫痫示例),则应应用最佳的靶向方法和刺激装置。
总结:
本文从电和磁的关系入手,通过亥姆霍兹互惠性(Helmholtz reciprocity)的基本原则,将脑电和脑磁,电刺激和磁刺激联系起来。文中阐述了上述技术的原理,头部建模、靶向定位的重要性,以及相关技术在脑机制理解,以及癫痫、脑卒中、焦虑症、精神分裂症等疾病治疗中的应用。
如需原文及补充材料请添加思影科技微信:siyingyxf或18983979082获取,如对思影课程及服务感兴趣也可加此微信号咨询。另思影提供免费文献下载服务,如需要也可添加此微信号入群,原文也会在群里发布,如果我们的解读对您的研究有帮助,请给个转发支持以及右下角点击一下在看,是对思影科技的支持,感谢!

微信扫码或者长按选择识别关注思影
非常感谢转发支持与推荐
欢迎浏览思影的数据处理业务及课程介绍。(请直接点击下文文字即可浏览思影科技所有的课程,欢迎添加微信号siyingyxf或18983979082进行咨询,所有课程均开放报名,报名后我们会第一时间联系,并保留已报名学员名额):
脑电及红外、眼动:
重庆:
第四届脑电机器学习数据处理班(Matlab版本,重庆,9.24-29)
第二十七届脑电数据处理入门班(重庆,10.28-11.2)
北京:
第三十九届脑电数据处理中级班(北京,10.11-16)
更新:第十三届眼动数据处理班(北京,10.26-31)
上海:
第二十五届近红外脑功能数据处理班(上海,10.17-22)
第三十六届脑电数据处理中级班(上海,11.13-18)
南京:
第五届脑电机器学习数据处理班(Matlab版本,南京,11.3-8)
核磁:
重庆:
第九届脑网络数据处理提高班(重庆,10.13-18)
第七十届磁共振脑影像基础班(重庆,10.22-27)
第二十八届弥散成像数据处理班(重庆,11.5-10)
南京:
第三十三届磁共振脑网络数据处理班(南京,10.16-21)
第二十二届磁共振脑影像结构班(南京,10.24-29)
第七十一届磁共振脑影像基础班(南京,11.12-17)
上海:
第二十四届脑影像机器学习班(上海,10.9-14)
第三十一届磁共振脑网络数据处理班(上海,10.28-11.2)
第六十九届磁共振脑影像基础班(上海,11.4-9)
北京:
第十届脑网络数据处理提高班(北京,10.20-25)
第十一届磁共振ASL(动脉自旋标记)数据处理班(北京,11.3-6)
第七十二届磁共振脑影像基础班(北京,11.9-14)
第六届影像组学班(北京,11.25-30)
数据处理业务介绍:
思影科技功能磁共振(fMRI)数据处理业务
思影科技弥散加权成像(DWI/dMRI)数据处理
思影科技脑结构磁共振成像数据处理业务(T1)
思影科技定量磁敏感(QSM)数据处理业务
思影科技啮齿类动物(大小鼠)神经影像数据处理业务
思影科技灵长类动物fMRI分析业务
思影数据处理业务三:ASL数据处理
思影科技脑影像机器学习数据处理业务介绍
思影科技微生物菌群分析业务
思影科技EEG/ERP数据处理业务
思影科技近红外脑功能数据处理服务
思影科技脑电机器学习数据处理业务
思影数据处理服务六:脑磁图(MEG)数据处理
思影科技眼动数据处理服务
招聘及产品:
思影科技招聘数据处理工程师 (上海,北京,南京,重庆)
BIOSEMI脑电系统介绍
目镜式功能磁共振刺激系统介绍