发表在NeuroImage杂志上的一篇文章使用了动态因果模型(DCM)方法探究婴儿大脑的功能连接情况,该研究由伦敦大学的研究团队主导,首次证明将DCM运用于婴儿数据的高可信度。
目前追踪发育中(从婴儿期到儿童期)的大脑功能连接是一个热门领域,fNIRS是一种研究婴儿大脑的理想方式。但是与fMRI相比,fNIRS的数据分析方法尚不成熟。动态因果模型(DCM)是为fMRI数据开发的一种先进的连接技术,旨在估计大脑区域之间的耦合以及如何通过实验条件的变化来调整这些耦合。DCM最近已应用于成人fNIRS,但尚未应用于婴儿。本文提供了一种将这种方法应用于婴儿fNIRS数据的原理证明,以及使用同时记录的fMRI-fNIRS单个案例研究证明了该方法的稳定性,从而允许在未来的婴儿研究中使用该技术。
以往研究使用了一系列方法来探索成人、儿童和婴儿的脑连接性。一些研究人员在清醒的婴儿中使用了EEG,而大多数使用功能磁共振成像的研究集中在睡眠婴儿的静息状态连接性上。尽管这些研究揭示了人生第一年的连接性如何发展,但考虑到大脑在第一年逐渐成熟和不断变化,研究者们对大脑区域如何在功能上彼此相互关联仍然知之甚少。fMRI研究面临的一个挑战是,在睡眠期间测量的连接性和清醒状态时显示出不同的激活模式,这表明睡眠阶段对功能网络的影响是不同的。fMRI对头动很敏感,即使是1mm的头动也会影响对婴儿脑连接性的分析。因此在婴儿的自然睡眠状态下,将会影响其脑功能连接的估计。这意味着在MRI扫描仪中从清醒的婴幼儿身上获取可用的数据非常困难,这限制了对于婴幼儿参与者可以使用的刺激和条件的范围。因此,本文旨在验证一种先进的功能连接技术的使用,以便将来可在清醒的婴儿上应用该方法。
fNIRS造价低,受头动影响小、时间分辨率高以及适用于社会互动相关研究的特点使其适于研究婴儿。其中高时间分辨率这一特点使fNIRS能够更准确地记录大脑的血流动力学波动,从而为使用连接性分析的研究以及探究时间序列和大脑区域之间的关系提供更高分辨率的信息。fNIRS研究领域的兴起激发了研究者们对其数据分析方法的不断探究,在本篇文章中,作者对fNIRS和fMRI的连接性分析进行了简单的归纳总结,发现绝大多数fNIRS连接性研究将“功能连接性”定义为空间远程神经生理事件之间的时间相关性。在这种情况下,相关性和相干性方法已被广泛应用于神经影像学,尽管这种方法只能告诉我们哪个体素/通道显示出与另一个并不一定在空间中接近的体素或者通道类似的波动模式。功能连接性是用“统计依赖性”来描述的,所以它没有提供任何关于实验条件或心理变量如何调节其模式的进一步概念。
1)为了将功能连接与实验条件联系起来,可以使用心理生理学相互作用(PPI)模型,但迄今为止,只有一项研究将PPI应用于fNIRS。它的缺点是不能提供神经依赖的方向性和因果关系;
2)格兰杰因果分析,GC方法的一个缺点就是它将因果关系的推断建立在一个时间序列相对于另一个时间序列的时间先后的基础上,推断出一个区域中较早的响应预示着另一个时间序列中的后续响应。其次,GC几乎不考虑大脑中的区域间变化,并且它不能告知我们关于连接的性质,即它们是兴奋性的还是抑制性的;
3)动态因果模型可以更精确地定义逼真的人脑网路,它支持神经元组群之间相互作用的非线性和动态性质。这种方法提供了一个特定大脑网络下的神经元和生物物理状态的生成模型,建立了不同脑区神经模式的模型以及它们相互作用的方式。DCM是评估有效连接性的最准确技术,因为它不仅可以评估在脑区之间的耦合,还可以评估它们如何受实验环境变化的影响。
此外,这种先进的方法考虑了两种不同的选择,实验条件可以进入模型;要么通过直接影响特定的脑解剖区域,要么通过调节大脑区域之间的耦合,因此影响不同区域之间的功能连接。通常,研究人员建立一个具有略微不同连接或实验背景的模型家族,并使用贝叶斯统计来确定哪个模型给出了最接近的数据描述(对模型空间的推断),并估计连接的强度和性质、兴奋性或抑制(对参数空间的推断)。这也正是DCM如此具有创新性和突破性的原因。
DCM虽然已经被广泛地应用于fMRI以及成人fNIRS的研究中,但是还没有运用到婴儿的fNIRS研究。本研究的主要目的就是填补这一空缺。接下来我们就来详细看一看这一实验是如何进行的。为了验证DCM于fNIRS婴儿数据的有效性,本研究采用个案研究法:同时采集一名睡眠状态下的6月大婴儿的fNIRS和fMRI数据。此外研究者也采集了MRI的扫描数据。接下来我们就详细看看研究者如何开展这一研究的。
研究方法
下图展示的是fNIRS、fMRI以及MRI数据的分析框架。
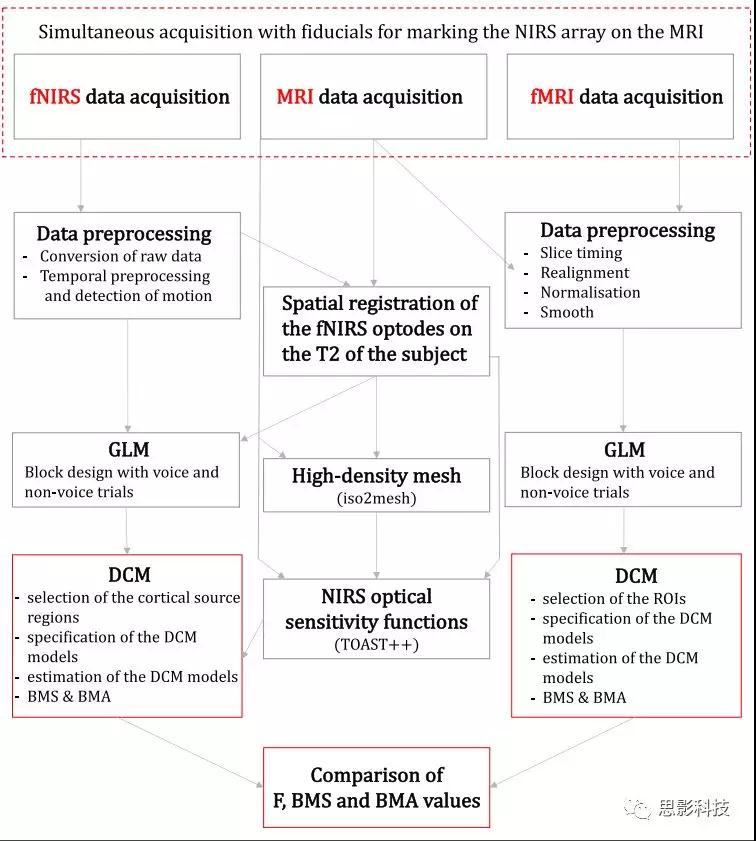
图1.数据分析框架
数据获取
被试为一名自然睡眠状态下的183天大的婴儿。和Blasi(2011, 2015)等人以及Lloyd Fox(2012a)的研究中使用的研究方案一致,本研究中有两种实验条件:听着人为声音(比如咳嗽声)或者自然环境下的声音(比如流水声)。实验为Block设计,实验条件的呈现时间为9秒,不同实验条件之间的rest时间为13秒,session时长总共为11.5分钟,一共有24个trial,其中12个实验试次为声音条件(V),另外12个为非声音条件(NV)。
fMRI
MRI数据由美国General Electric公司生产的1.5 T扫描仪获得。在平行于前联合 -后联合(AC-PC点)的24个不连续的轴向平面(4.0毫米厚,间距1.0毫米;3.5毫米的平面分辨率)的每一个中获得320个描绘BOLD对比度的T2加权梯度回波平面多切片数据集(TE 57 ms, TR 3000 ms, flip angle 90, 16:04min)。在同一个session中上,获得了T2加权快速自旋回波(FSE)数据集(256×168矩阵,2mm切片厚度,0mm切片间隙,18cm视场,TR 4500,TE 113ms,回波列长度17)。通过使用自动化质量控制程序来确保高信噪比和优异的时间稳定性。体线圈用于射频传输,8通道头线圈用于射频接收。在整个扫描程序中如果婴儿醒来和或表现出不适,就立即停止。实验者和家长站在扫描仪房间随时观察婴儿的行为。
fNIRS
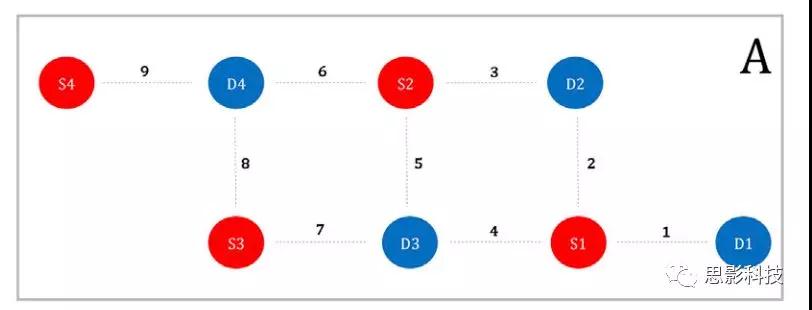
将fNIRS光极板(伦敦大学学院光学成像系统(Everdell等人,2005))置于被试右颞叶上,包括由4个源和4个探测器, 9个通道,发射端和接收端距离 2cm。NIRS系统中的光源提供770 nm和850 nm的光,采集采样率为10 Hz。MRI基准标记物被附在NIRS阵列光极之间的空隙以此指导NIRS数据在MRI图像上的配准。下图显示了该阵列的设计:
数据预处理
fMRI
所有的fMRI数据使用SPM12进行分析。对扫描图像的切片时间和头动进行校准,然后将图像Normalize到被试的T2图像中,并且使用7mm全宽度和半最大各向同性高斯核进行平滑。
fNIRS
使用SPM-fNIRS工具箱(一种基于SPM12的用于fNIRS信号的统计分析的软件)分析fNIRS数据(Tak et al., 2016; Ye et al., 2009)。使用改进的比尔朗伯定律(差分路径长度因子,DPF = 5.13将原始强度数据转换为血红蛋白变化。时间预处理包括去除生理噪声:5阶巴特沃斯高通滤波器:0.008Hz; 带阻滤波器:0.06-0.16 \ 0.8-1.8Hz;以及使用样条插值减少运动伪影。依据迄今为止唯一一项将DCM应用于fNIRS数据的研究(Tak et al.,2015),人为因素被检测为移动标准偏差的变化。研究者对fNIRS数据的分析基于oxy-Hb的变化。此外,之前对婴儿的fNIRS研究通常没有发现任何统计学显著的脱氧Hb变化。
空间配准。对于脑功能连接分析来说,对光极位置和参考点的精确估计至关重要。因此在将fNIRS空间配准到MRI图像上的这一过程显得尤其重要。因为婴儿大脑和成人被试大脑差异较大(不仅仅是尺寸上的差异),研究者使用被试自己的结构图像进行了NIRS数据的空间配准。
根据被试的T2结构像上的基准标记手动估计头部的光极位置。具体而言,研究者将每个基准点在头皮上的投影点定义作为每个NIRS通道的位置如图B。我们将基准点的中心估计为每个源与检测器之间的中点,因此它们标记了通道的中心。研究者据此计算了婴儿头上每个光电管的确切坐标。使用NFRI工具箱中的自定义修改代码,将婴儿的结构图像load到SPM-fNIRS中。如图C,在该这张结构图上绘制参考点和光极图。

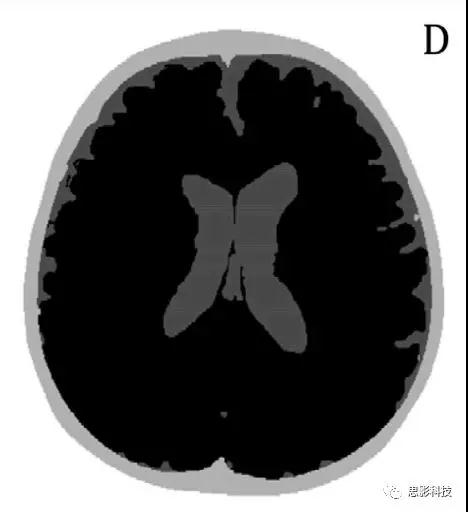
网格的分割和创建。收集了被试两次结构扫描的数据:功能数据收集之前和之后。两幅图像重叠显示婴儿在两个时间点之间几乎没有移动,因此两幅图像被平均并补强以提高其质量。之后,将图像平滑以去除由磁场引起的强度水平不均匀性,然后使用在Matlab中编写的内部脚本来移除其背景。使用FSL对结构像进行头颅剥离:具体地,使用BET(Brain Extraction Tool)程序(包括BET2)分离大脑;使用BETSURF分离头皮和内颅骨表面(http://fsl.fmrib. ox .ac.uk/fsl/fslwiki/FSL)。然后用SPM的SEGMENT选项进一步处理大脑图像,本步骤采用来自年龄适当的分割模板的组织概率图
(from theNeurodevelopmental MRI Database, of the Univ. of South Carolina http://jerlab.psych.sc.edu/NeurodevelopmentalMRIDatabase/)。其中使用了非常轻微的偏差调整0.0001,以及30 mm 的FWHM高斯平滑度误差界限。在这个过程结束时,婴儿的结构像分为3种:皮肤和颅骨以及脑外组织,CSF和脑(灰色和白质)。使用另一组Matlab脚本,对这三种进行后处理以填补空白并确保所有体素被分配正确的标签。正如前一节所述,分割的图像被用来提供必要的解剖信息到fNIRS数据重建步骤,如下图D。
从3种分割图像中,可以使用iso2mesh工具箱(https://sourceforge.net/
projects/iso2mesh/?source=typ_redirect)获得高密度的体积四面体网格。使用该工具包自带代码,光极坐标从MRI结构图像上转换为基于网格的坐标。网格上的光极位置以及由结构扫描产生的网格本身被用作估计NIRS光学灵敏度函数的输入。
NIRS光敏函数
应用DCM技术需要估计不同波长的光学测量对感兴趣区浓度变化的敏感性。在漫反射光学成像的背景下,这些灵敏度函数被称为光子测量密度函数。必要的灵敏度函数由给定光源产生的前向场的乘积和通过在检测器的位置放置等效光源产生的伴随场计算。为了计算前向和伴随场,扩散方程与Robin边界条件一起使用:

使用TOAST++工具箱(http://web4.cs.ucl.ac.uk/research/vis/toast/)通过有限元方法数值求解扩散近似。在每种情况下,根据物理测量指定源和检测器的性质。
fMRI和fNIRS的一般线性模型
对于fMRI和fNIRS数据,诱发的血液动力学响应被模拟为在一般线性模型(GLM)范围内与血流动力学响应及其空间和时间导数卷积的δ函数。声音(V)和非声音(NV)试验的起始时间以秒为单位。
选择ROIs /皮层源区域和DCM模型的定义
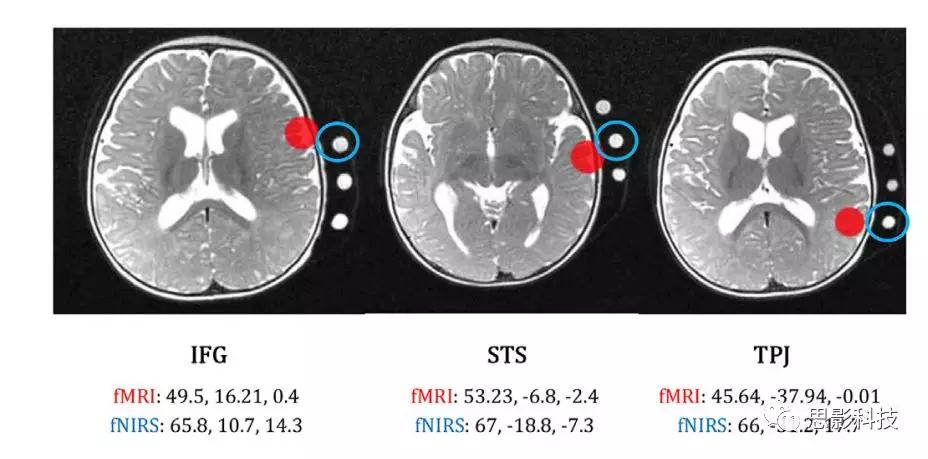
为了估算与DCM的有效连接,我们选择了IFG, STS和TPJ作为先验感兴趣区。功能磁共振成像ROIs的选择是基于GLM显示的最大激活峰值,并考虑以前关于听觉处理的相关文献。fNIRS皮层源区域基于先前的配准工作(Lloyd Fox等人,2014),考虑与感兴趣区域最近的通道的坐标(fNIRS源区域需要在被试的皮质表面上指定)来定义。在fMRI和fNIRS情境中,我们都提取了以ROIs /皮层源区域为中心的4mm球体中的主要特征体。参见图3中fMRI和fNIRS的具体坐标(其中红色实心圆代表的是fMRI的感兴趣区,蓝色代表的是fNIRS的感兴趣区)。
该研究中的DCM分析限于右半球,研究者利用fMRI和fNIRS对不同种子感兴趣区域(IFG,STS,TPJ在右半球)的差分状态方程进行建模。每个DCM模型可以由以下方式进行定义:(i)指定一个神经元群体的当前状态的一组内在连接(A);(ii)指示哪些内在连接依赖于实验操作的一组调节连接(B); iii)驱动输入(C),被认为是刺激对输入连接涉及区域的神经活动的直接影响。使用DCM-SPM工具箱以及DCM-fNIRS工具箱构建针对V和NV两种实验条件的13种具有不同的调节作用的模型。所有模型都被定义为双线性和确定性的。V和NV的听觉输入通过在所有模型中直接激活STS进入网络。在所有的假设模型中,我们确定了STS和TPJ以及STS和IFG之间的双向内在联系。这些模型因存在或不存在V和NV听觉处理对连接的调节作用而异。如下图即是所有可能的模型:
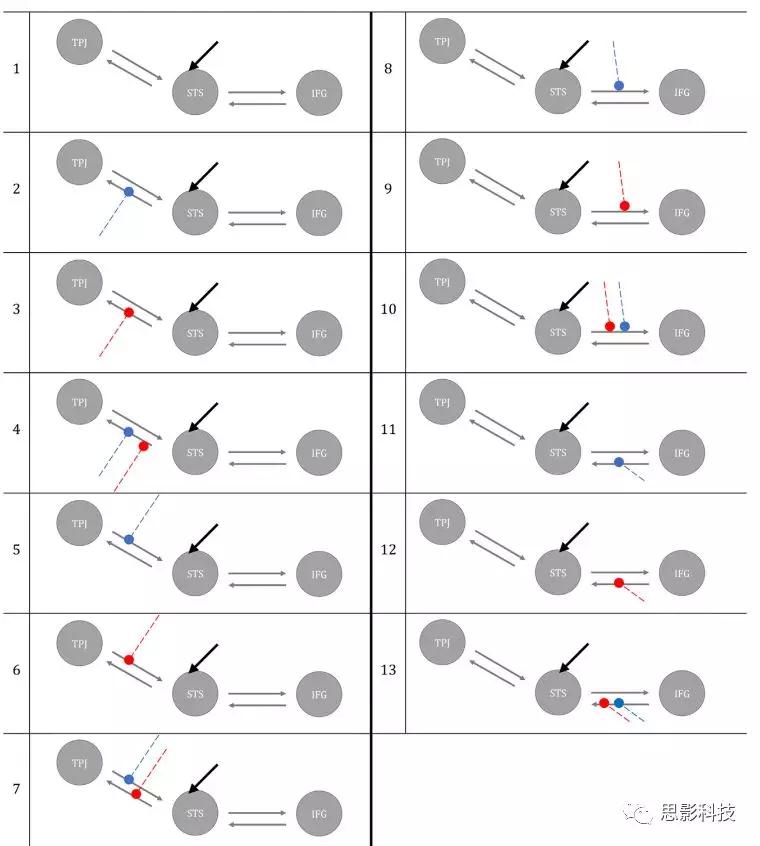
Specification和DCM模型的估计
将DCM模型拟合到试验平均的光密度信号。具体而言,fNIRS数据的生成模型是通过将光学方程式与血液动力学和神经动力学方程联系起来而创建的。然后使用建立的贝叶斯框架(变分拉普拉斯)根据fNIRS数据估计DCM参数,以此来推断关于神经元水平的定向连接性的变化。在这项研究中,研究者通过向灵敏度矩阵添加比例因子来增强用于DCM-fNIRS分析的光学模型:

这里的y指的是光密度的变化的测量;ƐH和ƐQ是氧合血红蛋白和脱氧血红蛋白的消光系数。
fMRI-fNIRS DCM model comparisons
在对fMRI和fNIRS数据的每个模型进行统计估计之后,对用fNIRS和fMRI估计的DCM模型进行比较以评估两种方法之间的有效连接对应性。DCM模型的比较主要基于变分自由能(F),它被认为具有最佳的模型选择能力,并且强烈推荐用于比较,主要在高信噪比条件下,如婴儿数据。应用贝叶斯模型选择(BMS)来估计fMRI和fNIRS数据的最佳模型。研究目的不是探究一个特定模型在BMS胜出的原因,而是为了研究fMRI和fNIRS数据之间是否存在任何趋同,从而回答方法论而不是认知问题。接下来研究者估计每个模型的fMRI和fNIRS的连接强度,以调查这两种方法之间是否存在任何对应关系。
结果
图5展示的是相应的F值以及fMRI和fNIRS之间的BMS比较。图6展示的是用fMRI和fNIRS估计的BMA值之间的相关性。结果发现fMRI和fNIRS DCM模型之间的高度对应关系(图5A)。此外,BMS显示模型8为fMRI和fNIRS的log模型,其在STS→IFG连接中呈现NV的调节作用。Pearson相关性证实了fMRI和fNIRS与 BMS log evidence(r = 0.718,p = 0.006)之间的强相关(图5B)。为了评估fMRI-DCM和fNIRS-DCM结果之间对应关系的强度,我们使用了一种稳健回归方法来比较两个数据集中所有模型的参数估计值。我们发现用两种方法估计的13个模型的连接强度(BMA值)与内生连接高度相关(图6A)(F(1,89)= 5.55,p =0.020, R2= 0.058), 输入(图 6B) (F(1,24) = 4.35, p =0.047,R2 =0.153), 在声音条件下的调节效应(图 6C和 D) (F(1,6) =16.4,p = 0.006, R2 = 0.732) 以及在无声音条件下的调节效应 (F(1,6) = 6.65,p = 0.041, R2= 0.526).
此外,研究者用bootstrap重复了回归分析: 内在连接(图7A)(F(1,89)= 5.63,p =0.019,R2= 0.059,CI = 0.114,0.855);输入 (F(1,24)= 4.67,p =0.040,R2= 0.163,C.I. = -1.712,- 0.353);调节作用(图7C和D))= 20.2,p =0.004,R2= 0.771,C.I. = 0.17,0.43)和NV(F(1,6)= 7.6,p =0.033,R2= 0.559,C.I. = 2.67,3.7)。
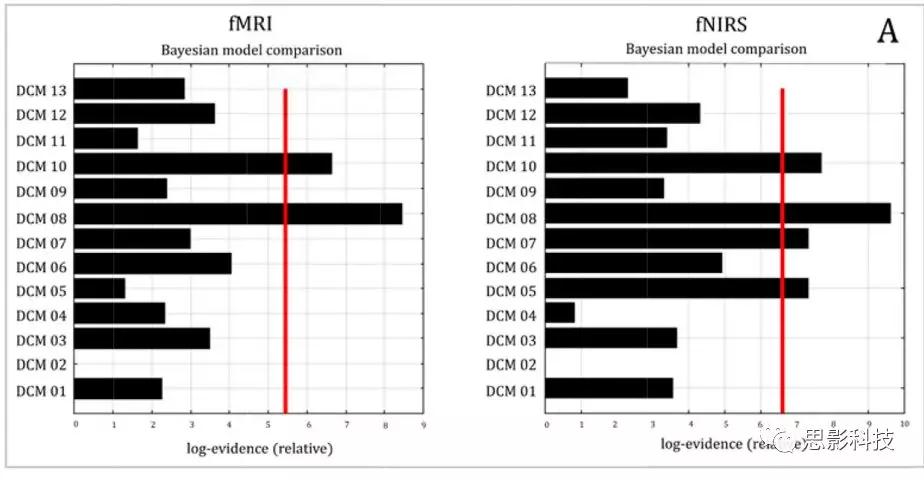
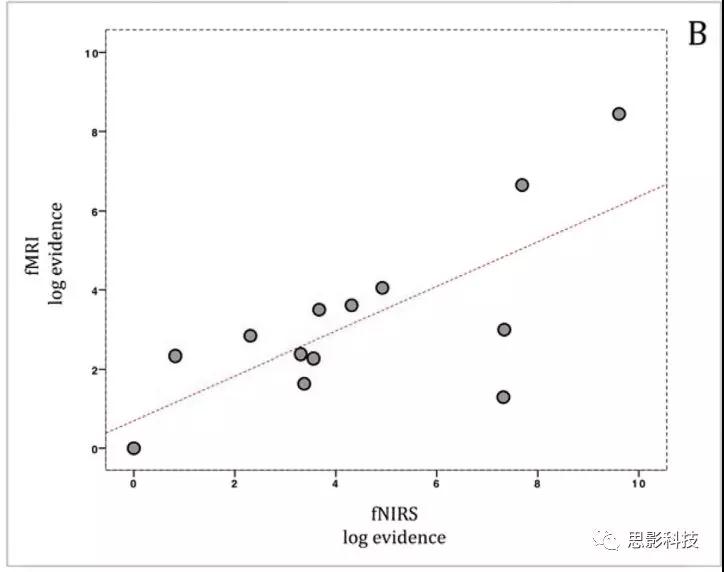
图5. A表示用fMRI和fNIRS估计的贝叶斯模型选择。 B表示13个DCM模型的fMRI和fNIRS对数之间的Pearson相关图。
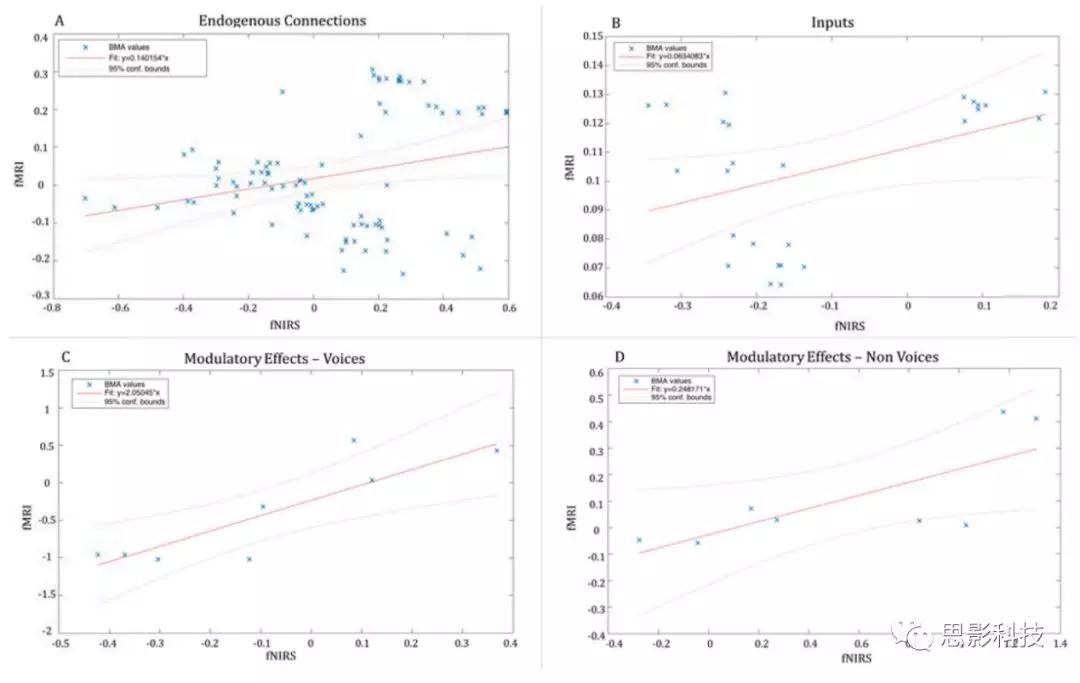
图6.用fMRI和fNIRS估计的BMA值之间的稳健回归
讨论
为了在婴儿数据上使用DCM模型,研究者克服了几个问题。他们成功地在NIRS工具包中引入了T2像,以便对连接结果进行更精准的估计。通过对T2像进行分割,可以重建被试的头部模型,并且定位光极位置。尽管本研究中只有一例婴儿数据,但结果也表明DCM模型对于探究婴儿数据的有效连接是可行的。作者表示,未来他们会在包含多个婴儿被试的数据集上测试DCM模型,并希望婴儿数据的研究者能更多地采用DCM相关方法。
参考文献: Okamoto,M., Dan, H., Sakamoto, K., Takeo, K., Shimizu, K., Kohno, S., Dan, I., 2004.Three- dimensional probabilistic anatomical cranio-cerebral correlation via theinternational 10-20 system oriented for transcranial functional brain mapping.NeuroImage 21 (1), 99–111. http://doi.org/10.1016/j.neuroimage.2003.08.026

欢迎微信扫码关注思影科技获取脑影像资讯和课程信息
获取原文:关注“思影科技”公众号,回复“原文”或“培训”,获取原文pdf及补充材料下载链接,同时欢迎浏览我们的课程通知及数据处理业务介绍。(点击下文红色字即可浏览):
第三届近红外脑功能数据处理培训班
第五届磁共振脑网络数据处理班
第八届功能磁共振数据处理基础班
更新通知:第二届脑电信号数据处理提高班
第四届磁共振弥散张量成像数据处理班
第三届磁共振脑影像结构班
