纽约州立大学精神病学系教授Meyers等人在Molecular Psychiatry杂志发表非洲血统家族中酒精依赖的内表型研究。快速beta节律(20-28Hz,以下简称beta)EEG振荡活动可能是研究神经超兴奋性(neuralhyperexcitability)疾病的遗传学有用的内表型(endophenotype),包括物质使用障碍(substance use disorders, SUDs)。然而,目前还未对非裔美国人血统(African-American ancestry,AA)的EEGβ节律的遗传基础进行研究。因此,该研究的第一目标:从酒精中毒遗传学合作研究(The Collaborative Study on the Genetics of Alcoholism, COGA)中挑选AA家庭,做beta节律(发生于双侧枕叶,前人研究中发现此节律具有高度的遗传性)的全基因组关联研究(Genome-wideassociation study, GWAS),这些AA家庭是最近确定的受到酒精依赖(AlcoholDependence, AD)和共同发生的外化障碍(externalizingdisorders,例如,SUD,ADHD)影响的家庭样本。第二个目标:探索GWAS发现的功能和行为学意义。
人类的脑生理振荡分为不同的频带(delta(1-3 Hz), theta (4-7 Hz), alpha (8-12 Hz), beta (13-28 Hz)和gamma(>29 Hz)),每一频带反映了不同的全脑状态(例如,alpha反映了放松状态,而beta反映了警觉状态)。有研究发现,beta与几种外化障碍有关(如,AD,SUDs, ADHD)。鉴于此以及以往在双生子研究中发现的beta的高度遗传性,研究者认为,beta是一个有用的内表型,用于识别个体这些障碍的潜在遗传因素。
之前有研究报告了酒精使用障碍(alcoholuse disorders,AUD)的beta(>19Hz)能量存在差异。此外,beta不受疾病严重程度的影响。由于酗酒者的后代在危险饮酒开始之前就存在升高的beta,因此,研究者假设,过高的beta功率是先于AUD的发展,而且,与发展为AUD的潜在遗传倾向是相关的,即beta可能是大量饮酒的原因,而不是大量饮酒的结果。Begleiter和Porjesz认为beta可能是大脑皮层兴奋-抑制失衡的电生理指标,而这容易发展为AUD。进一步支持这一假设的是beta与其他障碍的关联,如行为障碍,儿童、青少年的外化障碍,ADHD,网络成瘾等。
尽管双生子和家族研究发现了beta的高遗传性(49-85%),但鲜有遗传学对此进行研究,目前,仅有一项发现得到重复。重要的是,对AA群体还没有进行EEG的GWAS,因此在AA群体中还没有很好地描述EEG的相关性特征的遗传结构。在AA群体中进行遗传学研究除了考虑到公共卫生重要性之外,还因为疾病等位基因频率和连锁不平衡模式存在更大的遗传多样性和进化差异性。此外,AA饮酒者要经历更多与酒精有关的问题,包括社交问题,疾病和死亡,这说明需要识别减轻导致问题饮酒风险的因素。因为研究基本的大脑功能与人类的行为和障碍的关系的最终目标是提供对所有人的预防和/或干预,这一问题的理论需要加以解决。鉴于beta具有高度可遗传的并且与几种外化行为以及SUDs有关,beta的遗传分析可能有助于我们理解有一系列外化障碍风险的个体的脑功能。因此,本研究的第一个目标是对AA群体进行EEG的beta节律的GWAS的研究。第二个目标是探索GWAS发现的功能和行为学意义。
该研究从COGA中选择482组家庭中的2382个AA作为被试,对其EEG静息态的beta节律进行GWAS。为进一步描述基因发现,该研究探索了GWAS变异体的功能和临床/行为意义。结果显示位于染色体3q26的基因区间上的10个相关的单核苷酸多态性(SNPs)(r2> 0.9)与beta节律相关(P < 5 × 10 - 8)。最显著相关的SNP是rs11720449(β= -0.124,p<4.5×10-9),也是丁酰胆碱酯酶(Butyrylcholinesterase,BCHE)在丘脑组织中表达的数量性状位点。10种中的4种全基因组SNPs与COGA的AA家庭的精神障碍酒精依赖诊断和统计结果有关联,其中两个(rs13093097,rs724372)已在独立的AA被试中被重复。在AA青少年(来自COGA家庭的后代)的分析中表明,rs11720469与重度饮酒(频率为24h内饮用5瓶酒以上)有关。该研究为3q26中的基因变异在神经和行为抑制中的作用提供了支持。这些新的基因发现强调了在基因研究中加入AA种群的重要性以及内表型方法的效用,以增强我们对成瘾易感性机制的了解。
实验方法:
关于酒精中毒遗传学的合作研究
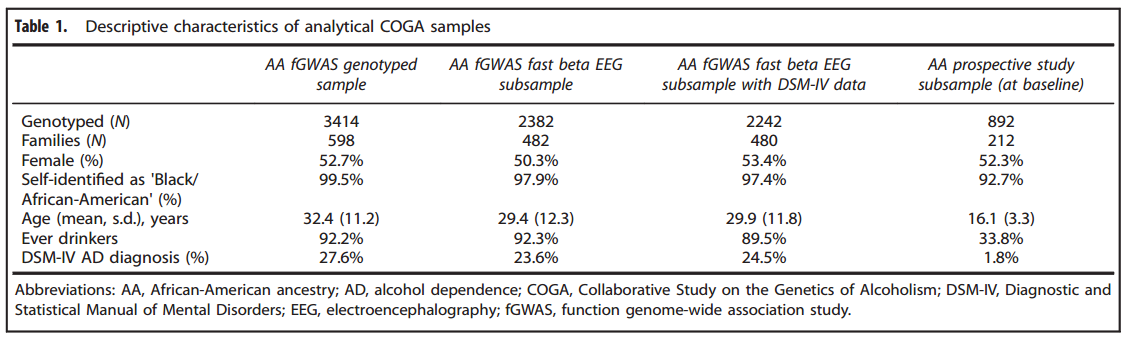
参与者接受酒精中毒遗传学的半结构化评估(TheSemi-Structured Assessment for the Genetics of Alcoholism, SSAGA),这是一个多诊断性的访谈。年龄在18岁以下的个体接受青少年版的SSAGA。还要收集他们的DNA和EEG。从GWAS数据中提取的主成分(Principalcomponents, PCs)被用来在全基因分型样本中分组为不同的祖先血统,同时也是选择AA家庭的基础。分析的样本包括来自482个家庭的2382个个体(Table1),有99.5%的AA个体(通过PCs定义)自我定义为黑人/非裔美国人,其中27.6%符合AD标准,其他共同发生的药物使用和外化障碍也是重要的标准,例如,可卡因依赖,ADHD。
2.EEG记录
记录闭眼静息EEG4.25 min,分析256s的连续时间段。本研究主要关注的是分布在双侧枕叶上(O1-O2),经过对数转换的绝对的beta节律(20-28Hz)的功率。
3. 基因型,归因和质量控制
使用Illumina2.5M阵列(Illlumina,San Diego, CA, USA)在遗传疾病研究中心对598个家庭的3414个人进行基因型分类。基因分型率小于98%或违反 Hardy-Weinberg平衡(p< 10-6)或次等位基因频率(minorallele frequency,MAF)<3的SNPs被排除。不符合孟德尔(Mendelian)遗传定律的数据被移除,使用SHAPEIT和IMPUTE2,数据被归因到1000个基因组(hg19)。接下来,基因型概率 ≥ 0.9被改变为基因型。根据Wetherill等人的描述,在被分类的SNPs中,Mendelian错误被重新估计和解决。归因信息得分 < 0.3或MAF < 0.03的SNPs在随后的分析中被删除。
4.GWAS
使用线性混合模型对在GWAF(Genome-wideassociation analyses with family)中的12972748个SNPs进行GWAS分析,并且纳入遗传关联矩阵(geneticrelatedness matrix)来控制家庭样本中的亲缘关系。因为性别和经过对数转换的年龄(EEG记录时)都与β节律有关(p< 0.001),因此在模型中,他们作为协变量存在。为进一步减少由于群体分层导致的假阳性,从SNPRelate计算得到的前10个PCs(PC1-PC10)也作为模型协变量,假设了一个额外的遗传模型。最后使用p< 5×10-8表示为全基因组显著性的阈限。利用全基因组复杂性特征分析(Genome-widecomplex trait analysis, GCTA)确定样本中β节律的SNP遗传率。将遗传关联矩阵纳入家族聚类的遗传估计中。
5. 功能分析
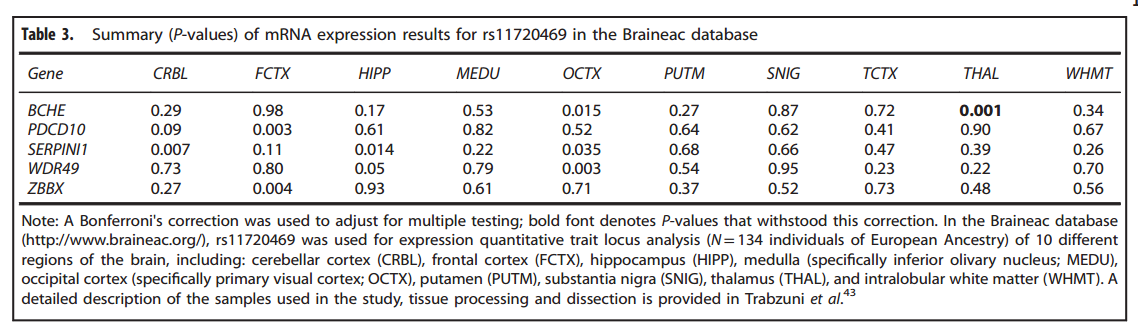
在英国脑表达协会(UKBrain Expression Consortium,BRAINEAC)中,我们检验了与beta节律最显著关联的变异体是否是一个表达的数量性状基因座(expressionquantitative trait locus,eQTL)。Braineac收集了来自134个欧洲血统的神经病理学正常个体的数据(Table3),并对10个不同的脑区进行评估。只有与β节律最相关的单个的SNP才在Braineac被分析从而使得多重测量达到最小化,所有的p值都经过Bonferonni矫正。在Genotype-TissueExpression Project(GTEx)数据库中,我们只分析了经受住多次测量还达到显著水平的遗传-β关联,以确定eQTL的发现。
6. 饮酒行为
我们确定了与β相关的全基因组变异是否也与样本(来自480个家庭中的2242人)中的DSM-IV AD(Diagnosticand Statistical Manual of Mental Disorders)相关。使用SAS9.4软件进行数据分析。根据年龄,性别,亲缘关系和PC1-PC10对逻辑回归模型进行调整。我们检验了所有的β的与全基因组显著的SNPs的相关。使用Pnorm程序对个体的p值进行调整,这一程序包括SNPs的LD结构(Linkagedisequilibrium patterns)和亲属的抽样。
接下来,在不相关个体的独立样本中(被招募来研究阿片类、可卡因或AD的基因,数据可在dbGaP上公开访问),我们研究GWAS变异是否与DSM-IVAD相关联。只有可以获得AD数据的AA个体才被纳入分析(1346个AD和461个控制组被试)。
最后,实验要求参与者:“思考过去的12个月,有多少次是在24小时内喝5瓶或者5瓶以上的酒?”(白的吗?),选项从“从不”到“每天”。在212个家庭中892人中,有33.8%的人曾经喝过大量的酒。剩余的66.2%是0。由于样本量相对较少,只分析与β最相关的SNP以最小化多重检验。在Mplus7.4中,使用对数转换后的重度饮酒者对此关联进行检验,并根据亲缘关系、性别、年龄和PC1-PC10对模型进行调整。
7. 事后检验
先前研究发现BCHE(或周边区域:3q26)与beta以及AUD(包括ADHD,可卡因使用问题)的行为学相关联。为了确定3种障碍(DSM-IV,DSM-IV ADHD, DSM-IV CoD)各自是否可以解释显著的beta信号,我们分别对3种疾病的beta的GWAS进行了事后检验,其中,每种障碍作为模型的协变量。
结果:
beta节律的GWAS
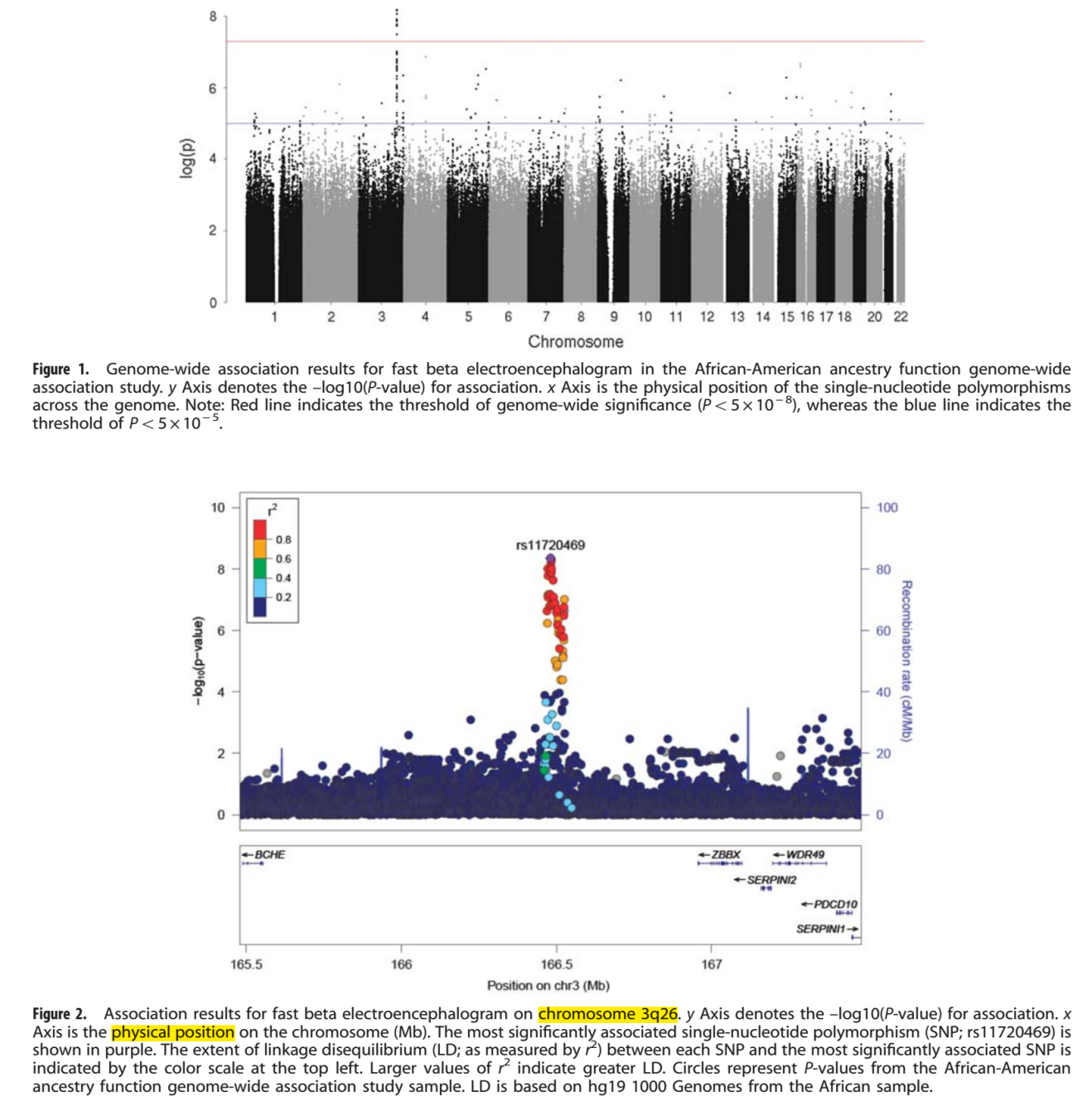
位于3q26上的基因间隔区域(Chr3, 166 471 942–166 489 551)的10个SNPs(基于非洲血统中的hg191000基因组的所有10个SNPs成对相关r2> 0.9)与beta节律相关(p< 5×10-8)(Table2,Figure 1,Figure 2)。最显著的SNP是rs11720469(p< 4.5×10-9),次要等位基因(G)与beta呈负相关(β= -0.124)。图2展示了GWAS信号以及已知基因上、下游的信号,包括BCHE,PDCD10, WDR49, SERPINI1, SERPINI2和ZBBX。GABRA2也与beta节律相关,但不是全基因组水平上(p< 0.01)。GCTA发现,在beta节律中,有33.8%的变异(s.e.:0.014, p < 5.5×10-17)是由于全基因组水平的SNPs(狭义遗传率)造成的。

2. 功能分析
在Braineac数据库中,rs11720469与BCHE,PDCD10, SERPINI1, WDR49和ZBBX的mRNA的表达相关。其中,经过Bonferroni矫正以后,只有一个结果依旧显著:rs11720469是丘脑组织中BCHE表达的eQTL(p= 4.20×10-4)。次要等位基因与减少的mRNA表达有关(Table3)。在GTEx数据库中,rs11720469与脑组织中BCHE的表达有关:大脑皮层(p< 0.007),尾状核(p< 0.005)。HaploRegV4.1指出在ROADMAP表观基因组学数据中,rs11720469改变了一些细胞的调控模式。
3.饮酒行为
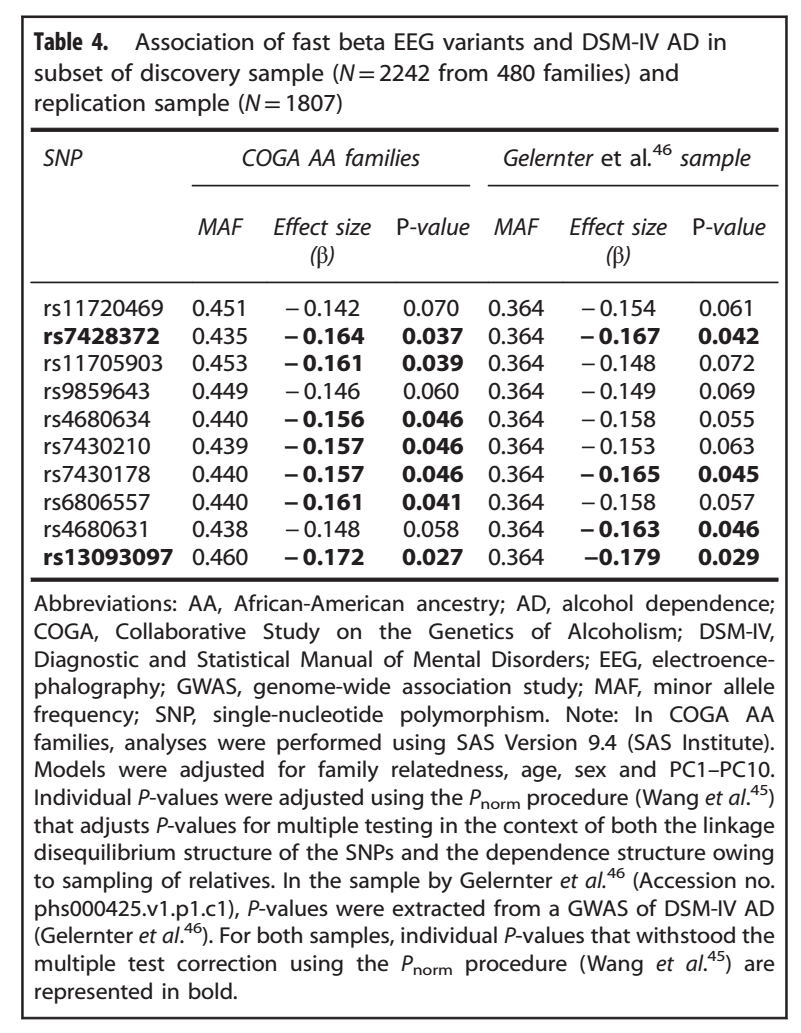
在GWAS的子样本中,与beta节律相关的10个变异中的7个也与AD有关(Table4);次要等位基因与减少的AD风险有关,表示一定的保护作用。考虑到在这10个SNPs中观察到的高LD,这些p值根据使用Pnorm程序估计的测试数量(1.2)进行调整,其中4个变异经过多重矫正后差异依然存在:rs7428372(β:-0.164,p < 0.037),rs11705903(β:-0.161,p< 0.039),rs6806557(β:-0.161,p< 0.041),rs13093097(β:-0.172,p< 0.027)。
在独立样本中,10个SNPs中的4个与AD有关(Table4)。经过多重比较矫正后,其中2个SNPs的相关依然存在:rs7428372(β:-0.167,p< 0.042),rs13093097(β:-0.179,p< 0.029),次要等位基因与减少的AD风险有关,表示着保护作用。
最后,来自COGA家庭的青少年/年轻成人的AA子样本,有一个或多个次要等位基因的副本与重度饮酒的减少有关(β:-0.064,p < 0.035),但是效应量不大。
4. 事后比较分析
在主要的GWAS样本中,beta能量越高的个体越可能符合DSM-IVAD, CoD和ADHD标准(all p < 0.001,Bonferroni矫正)。为确定其中一种疾病是否可以解释beta中观测到的显著信号,我们分别进行了3种障碍的beta节律的GWAS的事后检验,每一检验都将这些基因型之一作为协变量。AD作为协变量,3q26与beta的相关仍存在,但有些降低(rs11720469:β:-0.12,p:2.2×10-8)。DSM-IVCoD作为协变量,相关性仍在,但是有轻微减少(rs11720469:β:-0.122,p:1.3*10-8)。DSM-IV ADHD作为协变量,相关性减少(rs11720469:β:-0.088,p:6*10-4)。
结论:
这项研究是在AA样本中进行的,位于3q26的基因间隔区间上的信号与beta节律存在关联。最显著的SNP是一种BCHE的eQTL,它是一种与抑制障碍有关并在丘脑中表达的基因,丘脑是大脑中beta节律和AUD的核心脑区。此外,在已经发现的样本和独立样本中,beta节律全基因组相关的变异(rs7428372和rs13093097)与AD有关联。这些证据为3q26内的遗传变异在神经超兴奋性和以冲动性为特征的疾病中所起的作用提供了支持。另外,本研究证明了内表型方法的作用,而beta节律的遗传学发现提供了一个潜在的生物学假设(即神经超兴奋性),它可以增强我们对功能性大脑回路和AUD以及相关行为的易感性机制的理解。
未来研究方向:
1.该研究中的发现必须在更大样本量的AA个体中进行重复。未来的研究应该考察基因变异对发育过程中beta节律轨迹的影响,以确定特定年龄的影响以及这些影响和/或精神病理开始(AUD、ADHD、CoD)之间的联系。
2.未来的纵向研究可以探索ADHD、3q26和beta节律之间的联系(例如,beta节律可以调节3q26和ADHD之间的联系吗?)
3.随着beta节律与啮齿动物和人类的CoD联系在一起,应该进一步探索BCHE、beta节律和CoD之间的明显联系。
Meyers, J. L., Zhang, J., Wang, J. C., Su, J., Kuo, S. I.,Kapoor, M., ... & Kamarajan, C. (2017). An endophenotype approach to thegenetics of alcohol dependence: a genome wide association study of fast betaEEG in families of African ancestry. Molecularpsychiatry, 22(12),1767.
Doi: https://doi.org/10.1038/mp.2016.239

欢迎微信扫描二维码关注我们
获取原文:关注“思影科技”公众号,回复“原文”或“培训”,获取原文pdf及补充材料下载链接,同时欢迎浏览我们的培训通知以及数据处理业务介绍(点击下方橙色字即可浏览):
第九届脑电数据处理基础班
第三届脑电信号数据处理提高班
第四届近红外脑功能数据处理班
第一届眼动数据处理班
第十届功能磁共振数据处理基础班
第六届磁共振脑网络数据处理班
第二届动物磁共振脑影像数据处理班
第四届磁共振脑影像结构班
第五届磁共振弥散张量成像数据处理班
思影数据处理业务四:EEG/ERP数据处理
