摘要:
轻度认知障碍(mild cognitive impairment, MCI)是介于脑生理老化和痴呆(dementia)之间的一种状态。遗忘性MCI(Amnesic-MCI, aMCI)个体会发展成为痴呆症(通常是阿尔茨海默症Alzheimer-Dementia, AD),其年发病率是认知完整的老年人的20倍。意大利罗马天主教大学的神经学研究所Paolo Maria Rossini等人于2018年7月在Annals of Neurology杂志上发表文章。主要目的是探讨与Apo-E基因型相结合的EEG网络小世界属性(Small World,SW)是否能可靠地区分大约1年后将转化为AD的aMCI病人,为辨别高风险的aMCI受试者提供可靠、低廉、广泛使用并且无创的方法。根据临床随访结果,将145个被试分为两个小组:向AD转化的受试者(Converted to AD,C-MCI,71人)和稳定的MCI(Stable,S-MCI,74人)。结果显示,两组被试的SW在delta, alpha1, alpha2,beta2, gamma频带上差异显著,但C-MCI在基线状态与AD没有显著差异。基于SW的一阶多项式回归的接受者操作特征曲线(ReceiverOperating Characteristic Curve,ROC)显示出57%的敏感性,66%的特异性和61%的准确性(曲线下面积area under the curve:AUC=0.64)。
本研究同时测验了145个MCI中的97个被试的Apo-E等位基因。将遗传风险因素与SW相结合,结果显示:96.7%的敏感性,86%的特异性和91.7%的准确性(AUC=0.97)。只使用这97个被试的SW值,ROC结果显示50%的敏感性,69%的特异性和59.6%的准确性(AUC=0.63)。当采用不同类型的EEG分析方法(power densityspectrum,功率谱密度)时,准确性降低(68.86%)。这种创新的EEG分析与遗传测试相结合的方法(低成本并广泛使用)可以非常精确地评估MCI发展风险。这个评估可以用来筛选大量的人群,并在痴呆症的早期阶段迅速识别出aMCI。
关键词:精准医疗;图论;阿尔兹海默症;轻度认知障碍(MCI);功能连通性;EEG;α频带;eLORETA;转换;ApoE
Key Words: precisionmedicine; graph theory; Alzheimer; MCI; functional connectivity; EEG; alphaband; eLORETA; conversion; ApoE
方法:
被试:145个aMCI老年被试(女:82,男:63;71.83 ± 0.56 SEM;MMSE:25.87 ± 0.18)。在MCI的诊断后(追踪次数为0),根据临床症状变化情况被试分为两组:转化为AD的aMCI(aMCI-C)、稳定的aMCI(aMCI-S)。追踪结束时,在EEG记录中显示其结果。被试包括54个aMCI-S患者(年龄:70.72 ± 0.77SEM, MMSE:26.33 ± 0.27, 追踪的月数:38.17 ± 3.48; M/F: 33/41)和71个aMCI-C(年龄:73.05 ± 0.81 SEM, MMSE:25.32 ± 0.23, 追踪的月数:18.29 ± 1.60; M/F: 35/36)。在两组被试和个体层面,aMCI诊断和EEG记录至少间隔一个月。招募175个年龄匹配的AD患者作为控制组(年龄:72.23± 0.55, MMSE:20.12± 0.31, M/F: 81/94)。所有被试均为右利手。
被试选取标准:被试参加一系列神经心理学测试来评估其注意、记忆、执行功能、视觉构造能力和语言。记忆是通过对Rey听觉语言学习测试的即时和延迟回忆、Rey图片的延迟回忆、对3字列表的延迟回忆和对故事的延迟回忆进行评估的。MCI健忘症的诊断取决于至少一次情景记忆测试的损伤。记忆任务中表现的异常值阈限是低于健康人群的第五个百分位数。排除标准:创伤性脑损伤、癫痫、酗酒和任何其他神经和精神病的发生。这些病人经过仔细的筛选,以获得可能与认知障碍有关的医疗诊断(例如:肾脏或肝脏衰竭,甲状腺功能障碍,叶酸和/或维生素B12缺乏)。
每个被试填写了一系列问卷(大脑MRI和SPECT, MMSE [心理状况评估], CDR[临床痴呆评估],GDS[老年抑郁量表评估],HIS[Hachinski缺血指数量表]和IADL[日常生活量表的工具性活动])排除有其他原因造成的痴呆(额颞叶痴呆、血管性痴呆、锥体束外症状、可逆性痴呆、路易体痴呆)。这样做是为了生成临床同质组。
AD依据国家老年痴呆症协会工作组和DSMIV TR标准被诊断。受影响的个体表现出海马体积显著减少和颞角、脉络裂缝宽度的增加(在李克特量表上,2-4分),SPECT的血流量和氧消耗的模式也不正常。AD排除标准集中在:(1)额颞叶痴呆,(2)额颞叶痴呆的行为变异,(3)血管性痴呆,(4)锥体外综合征,(5)可逆性痴呆(包括抑郁症的假痴呆),(6)路易体痴呆。
根据指南和临床标准诊断健忘性MCI,aMCI的排除标准是:
(1) 根据标准协议,包括国家老年性痴呆协会工作组诊断的轻度AD;
(2)临床仪器诊断的伴随性痴呆,如额颞叶、血管和可逆性痴呆(包括假抑郁性痴呆),显著的认知能力波动,与路易体痴呆和/或混和痴呆特征相一致;
(3)伴随超锥体症状的证据;
(4)抑郁症的临床和间接证据,GDS的得分低于14(没有抑郁症); (5)其他精神疾病,包括癫痫、药物成瘾、酒精依赖症或使用神经/精神药物(包括乙酰胆碱酯酶抑制剂);
(6)当前或以前不受控制或复杂的系统疾病(包括糖尿病)或创伤性脑损伤。包括神经心理测验在内,每六个月进行一次随访进行追踪观察,用以发现MCI转换为AD的时间点。
数据记录和预处理:收集闭眼静息态EEG(至少5min),记录19个电极(Fp1、Fp2、F7、F8、F3、F4、T3、T4、C3、C4、T5、T6、P3、P4、O1、O2、Fz、Cz和Pz)上的脑电信号。使用Matlab对数据进行分析。采样率为256Hz,用有限脉冲滤波(FIR)进行带通滤波:高通为0.2Hz,低通为47Hz。在2s的时间段内,对眼电、肌电、心电和其他类型的伪迹进行检查。过程如下:1)研究人员对这些数据进行回顾,并通过EEG专家手动删除异常的波形;2)通过ICA(盲源分离算法)进行伪迹检查和删除。
功能连通性分析:
使用eLORETA软件进行EEG功能连通性分析。为了获得整个大脑的地形图,使用eLORETA软件对84个脑区进行连通性分析,将中心定位在左右脑区的42个布鲁德曼区(BAs: 1, 2, 3, 4, 5, 6, 7,8, 9, 10, 11, 13, 17, 18, 19, 20, 21, 22, 23, 24, 25, 27, 28, 29, 30, 31, 32, 33,34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47)。
需要评估的ROIs(兴趣区)用于分析大脑功能连接的电神经元活动。正如eLORETA所计算的,每个ROI的信号由属于该ROI的所有体素的平均电神经元活动组成。对每个半球,这84个ROIs之间的eLORETA电流密度时间序列,即颅内滞后线性相干intracorticalLagged Linear Coherence,使用全部最临近体素法(allnearest voxels method)提取出来,然后在这84个ROIs之间的所有两两组合中被计算出来,每一个组合都有7个独立的EEG频率(delta(2–4 Hz), theta (4–8 Hz), alpha1 (8–10.5 Hz), alpha2 (10.5–13 Hz), beta1 (13–20Hz), beta2 (20–30 Hz) and gamma (30-45 Hz)。
滞后线性相干性的计算公式:

(纯手工制作)
Var和Cov分别指信号的方差和协方差。
这一测量方法是真正的生理连通性的方法,而不受体积传导和低空间分辨率的影响,由所有ROIs配对计算而得到每个频率滞后线性连通性值,该值作为图论分析中脑网络的权重。
图论分析:
网络是由一系列节点(顶点)和节点间的联结(边)定义的。节点表示脑区,边表示解刨学上的、功能上的或者有效的联结。解剖学上的连接通常对应于灰质脑区之间的白质纤维束(皮层或皮层下传递)。功能连通性对应于活动中时间相关性的大小,可能发生在解剖学无关的区域之间。加权图论分析是不同权重(边)联结起来的一系列元素(节点)的数学表征。本研究中建立的是加权无向网络(脑网络的顶点是在BAs中估计的皮层源),并且边的权重是每对顶点的滞后线性值。使用大脑连通性工具包(theBrain Connectivity Toolbox)进行图论分析。
由于SW参数测量了局部连通性和脑网络全局整合之间的平衡,代表了大脑网络组织。因此,在全脑网络中计算SW参数。SW介于随机规则网络(较短的路径长度,但低水平的局部聚类系数)和完全规则网络(较长的整体路径长度,较高水平的聚类)之间,有相对较高水平的聚类和较短的路径长度。SW的测量是标准聚类系数CW与标准路径长度LW的比值。在进行SW测量之前,对数据进行标准化。标准化的特征路径长度通过所得值除以均值获得。均值是在7个EEG频率内,每个被试的特征路径长度的平均。标准化的聚类参数也是使用相同的方法计算。由于是从加权网络中计算,很难使用相同数量的节点和联结(所有连接都有效)来评估图论,因此研究者决定在每个频段内都使用相对值。
Apo-E测试:
选择97个被试检测血液基因型(年龄:71.46± 0.66 SEM, MMSE:25.98± 0.22)其中52个aMCI-S(年龄:69.85± 0.89, MMSE:26.74± 0.29,追踪月数:45.87± 3.94; M/F: 22/30),45个 aMCI-C (年龄:73.33 ± 0.92, MMSE:25.11 ± 0.27, 追踪月数:19.75 ± 1.82; M/F: 19/26)。Apo-E基因型是根据Hixson和Vernier所提出的成熟方法确定的。研究者进一步将MCI被试区分为Apo-E4非携带者(缺少ε4等位基因)和Apo-E4携带者(至少有一个ε4等位基因)。
统计检验:
eLORETA统计分析使用图论分析模块,使用sLORETA/eLORETA从脑网络中提取模块。使用Kolmogorov-Smirnov检验对数据的正态分布进行测验,并且符合高斯分布假设。为了证明研究假设,对SW值进行ANOVA分析,因素为组别(MCI-C、MCI-S)和频带(delta, theta, alpha 1, alpha2, beta 1, beta 2, and gamma)。另外,对SW值进行另一个ANOVA分析,因素为组别(AD、MCI-C、MCI-S)和频带(delta,theta, alpha 1, alpha 2, beta 1, beta 2, and gamma)。
多项式回归、ROC曲线和十折交叉分析(Polynomial Regression andROC curve and 10-fold cross validation):
数据包含145个被试在7个频带上(delta, theta, alpha 1, alpha2, beta 1, beta 2, and gamma)的脑网络SW值。根据在追踪过程中被试是否发展为AD,每个被试都做了标签。利用MATLAB的“fitlm”函数选择简单的多项式回归方程,该函数是使用最小二乘法拟合一个给定的多项式。该多项式包含8个系数:常数项、每个频带各一个系数。残差图近似正态分布表示选择了合适的多项式。
根据十折交叉分析工具,数据被随机分为10组,在对其他9组进行训练的同时,对所有组进行测试。最终值的计算是平均的结果表现和AUCs。
下面的指标测量了转换二进制分类器的性能:1)敏感性(Sensitivity):正确击中的比率(MCI-C)(即采用信号检测论得到的真阳性率);2)特异性(Specificity):正确拒绝的比率(MCI-S)(即采用信号检测论得到真阴性率);3)分类器的准确性(被试被正确分类);4)ROC曲线下面积(AUC)。研究结果只报告最优值(与最大准确性对应的截点)的敏感性、特异性、准确性。
最后,研究将Apo-E基因型纳入数据。数据同样包含97个被试在7个频带上(delta,theta, alpha 1, alpha 2, beta 1, beta 2, and gamma)的脑网络SW值。另外,纳入Apo-E4非携带者和Apo-E4携带者标签的多项式包含9个系数:常数项、Apo-E4、每个频带各一个系数。根据结果(在追踪过程中被试是否转化为AD),每个被试分配到一个标签。
结果:
临床和人口统计学数据:两组患者的临床和人口统计学数据没有差异(table1)。
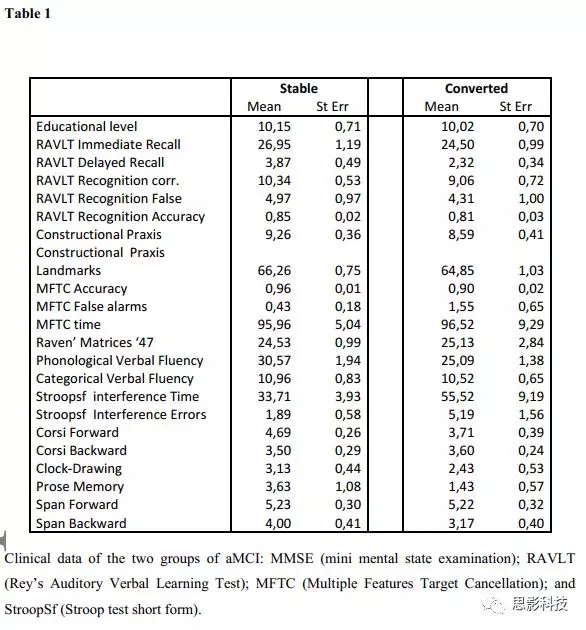
图论参数分析:
Cw(聚类系数)和Lw(最短路径长度)的重复测量结果显示,组别(aMCI-C, aMCI-S)与EEG频带(δ, θ, α1, α2, β1, β2, γ)交互作用显著(Cw: F(6,858) = 3.7042;p = 0.00122; Lw: F(6,858) = 4.1535; p <0.0004)。进一步的Duncan-planned事后分析显示在δ频带上,MCI-C被试比MCI-S被试有更高的Cw和Lw值(p < 0.04);在α1和α2频带上,MCI-C被试比MCI-S被试有更低的Cw和Lw值(α1:p < 0.004;α2:p < 0.011)。
SW的重复测量方差分析显示,组别(aMCI-C, aMCI-S)与EEG频带(δ,θ,α1,α2,β1,β2,γ)交互作用显著(F[6,858] = 7.6633;p < 0.00001)。进一步的Duncan-planned事后分析显示在δ、β2和γ频带上,MCI-C被试比MCI-S被试有更低的SW值(δ:p < 0.034;β2:p < 0.032;γ:p < 0.0001);在α1和α2频带上,MCI-C被试比MCI-S被试有更高的SW值(α1:p < 0.011;α2:p < 0.0005)。
为了评估AD被试的不同,执行了另外一个SW的两因素ANOVA:组别(AD,aMCI-C, aMCI-S)和EEG频带(δ,θ,α1,α2,β1,β2,γ)。结果显示存在交互作用(图1)。Duncan-planned事后分析显示,除了γ频带,其他频带上AD被试和aMCI-C被试没有显著差异。
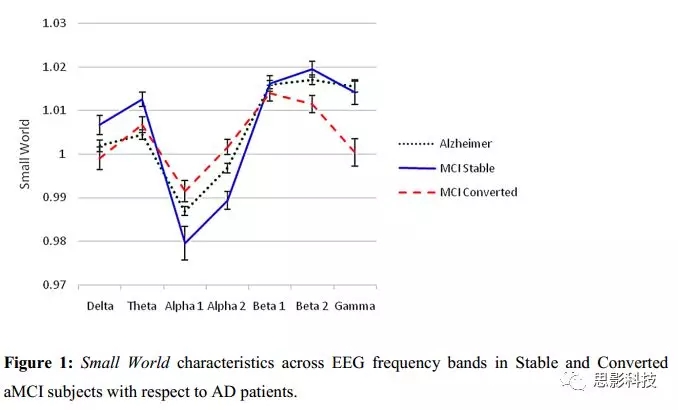
图2描述了通过滞后线性相干得到的aMCI-C、aMCI-S被试在各EEG频带上的功能性耦合分布。与前人研究相似,aMCI-C被试比aMCI-S被试在δ上有更高的耦合,在α上有更低的耦合(图2)。
Apo-E测试:
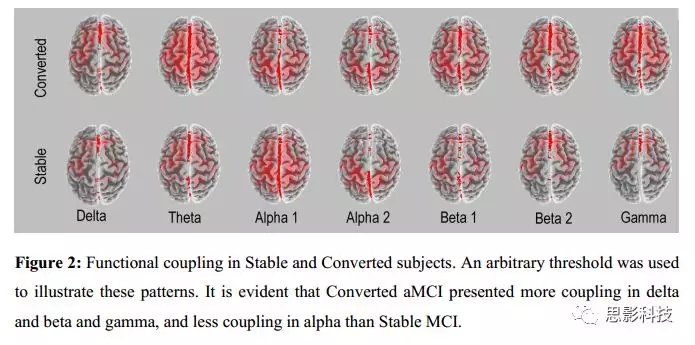
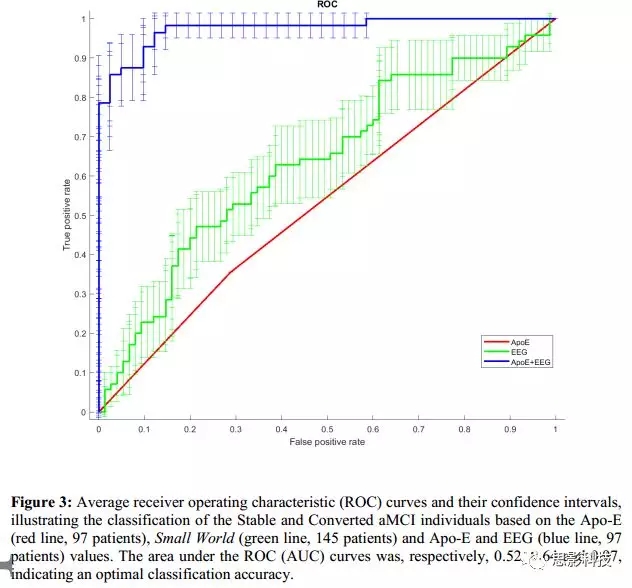
对97个被试进行了Apo-E分类。其中66个“Apo-E4non-carriers”(缺少ε4等位基因),有29个是aMCI-C被试(43.9%);31个“Apo-E4 carriers”(至少有一个ε4等位基因),有16个是aMCI-C被试(51.6%)。接受者操作特征曲线(Receiver OperatingCharacteristic Curve,ROC, 图3)显示,曲线下面积(Area under thecurve,AUC)为0.51。
基于SW对aMCI-C和aMCI-S被试的分类:
分类过程中,只考虑SW值(145个被试),ROC曲线的AUC值为0.64(图3中的绿线,表示中等程度的准确性)。作为AD的预测指标,aMCI状态的分类器结果显示57%的敏感性、66%的特异性和61%的准确性。
当把Apo-E基因型纳入分类过程后(97个被试),ROC曲线的AUC达到0.97。作为AD的预测指标,aMCI状态的分类器结果显示96.7%的敏感性、86%的特异性和91.7%的准确性,表示其准确性非常高。只是用这97个被试的SW值,ROC曲线的AUC为0.63。分类器结果显示50%的敏感性、69%的特异性和59.6%的准确性。
读者可将ROC曲线中的点密度作为对阈值变化稳定性的度量:很明显,最稳定的分类器是只依赖于Apo-E的分类器(虽然不是性能最高的),因为它只用0和1评估一个变量作为可能值。比较SW和SW+Apo-E,可以说明通过增加Apo-E基因型,分类性能和稳定性都提高。
控制分析:
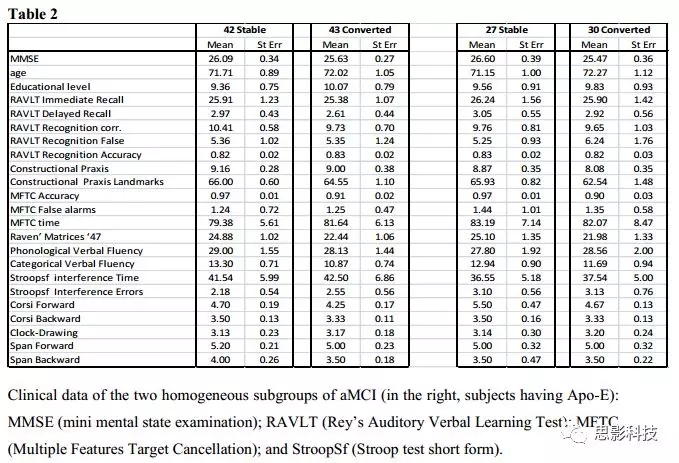
图4展示了与aMCI-C和aMCI-S有关的连接矩阵(表示基线功能脑网络拓扑图)。为了了解基线的差异是否会影响结果,研究者挑选了在人口统计学和认知参数上完全相同的两个亚组:包括42个aMCI-S和43个aMCI-C。其中,27个aMCI-S和30个aMCI-C也有Apo-E测试值(人口学数据见表2)。研究的结果与主要结果一致,ROC曲线的AUC为0.62,分类器的结果显示52%的敏感性、90%的特异性和61%的准确性。当将Apo-E基因型纳入分类过程时,ROC曲线的AUC为0.7;分类器的结果显示67%的敏感性、93%的特异性和65%的准确性。

是否需要一个“图论”模型支持目前的结果?为了回答这一问题,研究者将同类型的分类器与目前用于AD研究的其他脑电方法进行比较,并将所发现的分类器应用于相同的EEG分段,叫做谱相干和与Apo-E相结合的功率谱。当分析所有被试的功率密度谱时,研究获得了最显著的结果。为了解释头皮电极点记录的脑电谱功率密度,研究者使用sLORETA软件来解决三层头模型(three-shell spherical head model)的脑电逆问题并得出体素电流密度的值。然后,每个voxel的电流密度被标准化到所有频率(0.5-45Hz)的平均功率密度和所有6239个体素。归一化后,电流密度值失去了原来的物理维度,并且可以用任意单位尺度代表。这一过程也减少了被试间的变异性。
与所采用技术的低空间分辨率相一致,研究者用ROI标记sLORETA软件解出来的12个感兴趣区的体素叠加(ROIs,左右脑各6个,皮层感兴趣区的布罗德曼区:前额叶[8, 9, 10, 11, 44, 45, 46, 47],中央区[1, 2, 3, 4, 6],顶叶区[5, 7, 30,39, 40, 43],枕叶区[17, 18, 19],颞叶区[20, 21, 22, 37, 38, 41, 42]和边缘系统[31, 32, 33,34, 35, 36]),这12个感兴趣区是根据Talairach空间编码的。在每个皮层ROI的信号由属于该ROI的所有体素的平均神经元活动组成。为了描述在各EEG频带的脑活动,将不同体素的电流密度根据频段分组(δ:2-4 Hz;θ:4-8Hz;低频α:8-10.5Hz;高频α:10.5-13Hz;低频β:13-20Hz;高频β:20-30Hz;γ:30-45Hz)。根据数据,对本研究中的主要分析进行了分类,结果显示51.79%的敏感性、100%的特异性和68.86%的准确性。这些结果是显著的,但是没有想象中的显著。
讨论:
AD的临床表征有一个MCI的早期阶段(aMCI),在追求早期干预目标时,研究人员和卫生政策制定者对从aMCI到AD转变的早期生物指标特别感兴趣。即使没有疾病改善的治疗,早期药理和非药理疗法(包括生活方式改变)有助于维持日常生活中的个人自主和显著降低疾病管理的成本。因为当患者发展出AD的全部症状时,就已经失败了,许多进行潜在疾病改善药物的临床试验针对的都是AD的早期阶段(MCI患者)。因此,在早期阶段预测疾病发展的生物指标可能有助于早期诊断和干预,并用于识别可从实验药物试验中获益的个体。可以通过目前可用的一些诊断仪器实现这一目标(MRI,PET,PET+放射性物质/淀粉样蛋白和tau代谢物的腰椎穿刺),但他们对突触功能障碍有低敏感性并且价格昂贵,适用范围有限,有创伤性。由于这些限制,这些方法用于大规模的人口筛查是不可行的。一项元分析数据显示60岁以上的人群中,MCI的患病率为5.9%,在其不同年龄组中稳步发展(4.5%, 60-69; 5.8%, 70-79; 7.1%, 80-89),这些代表了以人口为基础,筛查的大量数字。近年来,越来越多的人关注疾病的电生理基础,这种方法可以用来评估通过大量的人口筛查,大脑EEG信号是否可以追踪从MCI到轻度AD的早期发展。因为这种技术的低成本、广泛使用以及无创性,人们对其兴趣增加。这篇文章的目的是当EEG频带分析(探索SW特征)与从Apo-E基因型中收集到的基因风险评估相结合时,这种方法作为一级筛查具有合适的敏感性/特异性,是否可以预测从MCI向AD转化的风险。这种相互结合的方式(EEG与Apo-E)已经被用于诊断健康老年人和AD患者的区别。但是这种方法还没有用于预先诊断的目的,也就是在MCI个体中区分前驱性AD和非前驱性AD患者。
健康的大脑组织反映功能整合和分离的最佳平衡,也叫做小世界(SW)。SW特征反映了由专门的功能分区组成的抑制和兴奋性大脑回路,这些功能分区在一个动态波动的恒定状态下,不断相互合作实现、分享并整合信息。这一恒定状态的波动受到多个变量的控制来影响脑网络功能执行。神经元群组之间的连接反映分离和整合过程,正如局部聚类(分离)和路径长度(整合)所揭示的那样。
MCI-C患者(尤其是1-2年快速转变为AD的患者)的SW体系与MCI-S患者有显著差异,但是两者EEG频带的SW分布一致。然而,研究还表明aMCI-C患者与AD患者转换前1-2年有着相似的SW特征。Xie 和He等人表示已经有很多研究以不同的方式研究脑网络的拓扑变化,并且研究了结构和扩散张量成像MRI、EEG/MEG和fMRI。因此,AD经常被认为是一种分离综合征,大脑拓扑结构可以通过中枢区域的大脑组织发展性错乱以及导致SW体系结构变化的长范围联结得到表征。事实上,由于局部和整体联结减弱,AD患者中的大范围功能脑网络组织偏离了最佳SW体系结构,转向更有序的类型(呈现出更低的SW值),进而导致在脑区之间,信息传递的效率更低。这一解释与AD患者分离假说一致。
相比于MCI-S患者,MCI-C患者的低频α频带的图论值异常增加,而δ和γ频带的图论值减少。这一结果可以根据α频带的生理功能来解释。α频带通常常被称为成人大脑的静息频带(idling rhythms),是构成闭目养神的正常EEG活动的主要特征。一些研究假设α频带是一个与记忆和感知觉过程都有着功能相关的确定性混沌信号。在健康个体中,α频带被解释为大脑中信息传递的基本形式。一些脑电研究发现α与信息处理的速度和认知性能呈正相关。有人认为在清醒状态下δ频带减弱,从而反映了类似于α-δ相互抑制的情况。众所周知,皮质区域解剖或功能上的分离会在几乎所有的神经元中产生δ频带上的自发慢波。δ频带上的SW减少代表了结构化的行为类型,可以被解释为δ活动的增加和功能抑制。MCI-C患者在γ频带上SW值的减少与前人的研究类似,这些研究表示AD患者比MCI和控制组被试的γ频带上SW值减少。γ频带(> 30Hz)包括记忆过程中调节皮层和海马结构之间的信息传递的高频EEG振荡,特别是通过前馈机制和来自不同结构的振荡之间的相干相位差。动物和人类研究都认为γ振荡在记忆任务中扮演重要角色。γ频带神经活动涉及许多认知功能(视觉对象处理、注意和记忆)并且在一些记忆任务中(探测情景记忆、编码和检索任务)与行为反应(正确率和反应时)有密切联系。此外,微电极颅内记录证明γ频带在脉冲相位同步中起着关键作用,这基于EEG连通性机制。
当使用所有被试对MCI-C患者进行分类时,EEG SW特征的ROC曲线呈现出> 60%的敏感性(AUC=0.64,表示中等程度的分类准确性)。依据前人的研究, AD患者的连通性模式比MCI患者更随机。在SW EEG频带特征方面,健康的老年MCI被试比AD患者呈现出更大的特异性,AD的低频频带更高,高频频带更低。最后,针对AD患者的控制分析发现aMCI-C和AD的图论模式相同。这些发现暗示与神经心理学结合的EEG连通性方法可以为确定aMCI-C的早期定义和解释有快速转化为AD的高风险被试提供很好的帮助。
当结合显型与基因型两种方法时,将MCI状态作为AD的前驱状态的分类过程中,准确率显著增加到91.78%(AUC为0.97,表示最优分类准确性)。这一结果依据Apo-E基因的ε4等位基因是后期AD发病源的主要遗传风险因素,并且这一结果暗示SW特征和Apo-E有助于以最少重叠的协同方式预测结果。研究也证实SW测量在Apo-E e4非携带者中发挥了重要的作用。值得注意的是,更同质的人群显示了更低的准确性,而这些同质群体的数量较少。
整体上来说,本研究的发现清晰地证明了ApoE基因型和EEG连通性反映了神经改变机制的不同原因,当两者结合时,他们能最好地相互整合。
图论模型是否优于AD诊断中的其他方法?为回答这一问题,研究者比较了当前AD研究中使用的其他EEG方法的相同类型分类器,并且将相同数据的结果运用到与Apo-E基因型相结合的频谱相干性和功率谱上。结果显示51.79%的敏感性,100%的特异性和68.86%的准确性。这些结果是有效的但是没有SW分析的结果显著。
EEG频带的内在特征包含了AD神经退化过程的相关信息。通过对突触传递和大脑动态连接的功效进行分析,这些过程早在临床症状显现之前就开始了。在aMCI-C患者中,SW特征为aMCI患者在短期内发展为AD提供了可靠的预测。此外,从aMCI到AD的快速发展预示着导致痴呆症的原因类型,其生活技能快速退化。
结论:
结合神经心理学MCI模式和Apo-E基因型的EEG连通性分析可以代表一种生物指标的组合,这对MCI前驱体转化为AD的早期识别有很大的帮助。这个结合是一个多模式、低花费、无创伤的方法。当结合起来时,这种方法利用广泛可用的技术,在个体基础上达到高敏感性/特异性和良好的分类准确性(高于0.97的AUC)。因此,这可以作为初次筛查,被用来有效的确定MCI患者发展为AD的风险。
Vecchio, F., Miraglia, F., Iberite, F., Lacidogna, G.,Guglielmi, V., Marra, C., ... & Rossini, P. M. Sustainable method forAlzheimer's prediction in Mild Cognitive Impairment: EEG connectivity and graphtheory combined with ApoE. Annals of Neurology.https://doi.org/10.1002/ana.25289

欢迎微信扫码或者长按二维码关注我们
思影科技给您带来最新脑科学资讯
获取原文及补充材料:关注“思影科技”公众号,回复“原文”或“培训”,获取原文及补充材料pdf下载链接,同时欢迎浏览我们的培训通知及数据处理业务介绍。(直接点击下方红色与紫色字):
第九届脑电数据处理基础班
第三届脑电信号数据处理提高班
第一届眼动数据处理班
第四届近红外脑功能数据处理班
第十届功能磁共振数据处理基础班
第六届磁共振脑网络数据处理班
第二届动物磁共振脑影像数据处理班
第五届磁共振弥散张量成像数据处理班
第三届磁共振ASL(动脉自旋标记)数据处理班
第四届磁共振脑影像结构班
第二届脑功能磁共振提高班暨任务态fMRI专题班
思影数据处理业务一:功能磁共振(fMRI)数据处理
思影数据处理业务二:结构磁共振成像(sMRI)
思影数据处理业务三:ASL数据处理
思影数据处理业务四:EEG/ERP数据处理
