重度抑郁症(Major Depressive Disorder,MDD)的神经生理学已成为经颅磁刺激(TMS)研究的关注点。TMS结合脑电图(TMS-EEG)的方法可直接测量背外侧前额叶皮层(DLPFC)的诱发活动。来自加拿大的成瘾与心理健康中心的Voineskos等人通过比较健康被试与病人,得出MDD组中DLPFC的TMS-EEG反应差异:具体来说,TMS-EEG标记物与抑制性和兴奋性神经生理过程及其平衡相关。本研究发表在最新的Biological Psychiatry杂志上。
方法:30名MDD参与者和30名年龄和性别匹配的健康参与者进行单脉冲TMS-EEG评估DLPFC的抑制和兴奋。通过全局平均场幅度分析TMS-EEG波形。
结果:MDD的DLPFC中TMS-EEG异常。抑制措施在MDD组的N45和N100比健康被试更大。 ROC分析中,N45波幅预测疾病状态的敏感性为80%,特异性为73.3%,准确性为76.6%(AUC = 0.829,p <0.001)。GMFA-AUC(全局平均场幅度-曲线下面积)在MDD中显著更大,P60也是一样。在健康被试中,抑制性N45与兴奋性GMFA-AUC之间存在正相关,但MDD中不存在,表明MDD的抑制和兴奋之间存在潜在的不平衡。
关键字:TMS EEG 重度抑郁症 背外侧前额叶(DLPFC)
前言:
在多种研究方式中重复发现左背外侧前额叶皮层(DLPFC)与MDD病理生理学相关联。MDD患者左侧DLPFC的功能减退在功能成像研究中显而易见。经颅磁刺激(rTMS)成为治疗左侧DLPFC的可行方案,在高频下用于激活MDD中的DLPFC。
经颅磁刺激(TMS)可用于测量皮质抑制和兴奋。TMS与脑电图(TMS-EEG)的组合已经支持了与MDD(例如DLPFC)更密切相关的脑区域中的神经生理指标的研究。
据我们所知,没有研究评估MDD患者DLPFC的抑制和激发的TMS-EEG测量。因此,在本研究中,我们的目的是检查MDD和健康受试者中DLPFC的TMS-EEG抑制和兴奋的差异。我们假设MDD的TMS-EEG在DLPFC中抑制和兴奋的神经生理学测量将显著改变。具体而言,鉴于以前的TMS-EMG对MDD皮质抑制的研究和MDD中观察到的前额叶功能低下,我们假设皮质活动的TMS-EEG测量将显示抑制(N45和N100)和兴奋(P60和GMFA-AUC)。
方法:
共60名被试,30名患有MDD,30名性别匹配的健康人,年龄匹配至2-1年内。MDD个体在治疗之前接受TMS-EEG测试作为基线。所有参与者都是右利手。汉密尔顿抑郁量表(HRSD-17)得分> 20,证明是活跃的重度抑郁发作。也按照一定的入选标准选择健康被试(排除精神病理学,在过去6个月内有过DSM-IV物质依赖史,有明显不稳定的医学疾病或癫痫病史等等)。
TMS
在左运动皮层和DLPFC上施用单相TMS脉冲。为了定位运动皮层,将线圈置于电极FC3和C3之间,是引发运动诱发电位(MEP)的最佳位置。确定DLPFC的最佳位置为额中回三分之一处的中间和前断的交界处[Talairach坐标(x,y,z)= [-50, 30, 36],对应于布罗德曼9区域的后部区域,与布罗德曼46区的上部重叠。并在对应的在EEG帽上标记相应的位置。
静息态运动阈限(RMT)
在每个实验开始时,通过将TMS的单脉冲施加到运动皮层中的最佳位置来确定RMT(resting motor threshold)。RMT定义为在10个试次中≥5次引发MEP>50μV所需的最小刺激强度,并且在定位EEG帽之前和之后确定一次。
EEG记录和分析
64导脑电,参考位于Cz。另外,四个电极放置在每只眼睛的外角上,以及左眼上方和下方。确定刺激强度,在20个试次中引起平均的峰-峰MEP振幅1mV。使用EEGLAB,FieldTrip和MATLAB中的自定义脚本(R2015a,The Mathworks,USA)进行EEG数据分析。TMS脉冲数据分段(-1000至1 000ms),基线校正(- 500至200ms)和TMS脉冲数据(-2至20ms)要被移除并进行线性插值。对数据进行降采样并检查极端噪声(即,肌肉运动,坏电极)。第一次独立成分分析来检测和去除TMS尾部和大幅度肌肉伪迹。滤波范围为1-100Hz和带通滤波(58-62Hz)。第二次独立成分分析从数据中去除其他伪迹(即眨眼,眼睛运动和肌肉伪迹)。然后用球形样条插值代替缺失的电极,并将数据重新参考到平均参考(在所有电极上)以进一步分析。
GMFA分析
计算诱发位置的最大振幅,用于评估大脑对TMS-EEG的反应。计算单个被试在GMFA内(局部最大)成分的峰值和潜伏期。在最终分析之前,检查所有成分。N45振幅计算为在45±10ms之间的GMFA的平均振幅。P60振幅计算为在60±10ms之间GMFA的平均振幅。N100振幅计算为在100±20ms之间GMFA的平均振幅。GMFA-AUC的计算为TMS脉冲后的55-275ms之间的GMFA的总和。
统计分析
所有统计分析用SPSS进行。计算MDD组的HRSD-17和ATHF的平均分数。使用Kolmogorov-Smirnov正态性检验评估数据的分布,因为两组的数据都不是正态分布的,进行了对数转换。对两组进行独立样本的t检验:N45、P60和N100振幅和GMFA-AUC值。考虑到进行多重比较的可能性,我们将alpha设置为0.0125(N45,P60,N100,GMFA-AUC)。对MDD,在GMFA1成分和顺序变量(HRSD-17评分,HRSD-17的自杀评分,ATHF得分和性别)之间进行Spearman的相关性分析,对所有被试的GMFA成分和性别之间进行Spearman相关性分析。两组的GMFA成分和年龄(年)(两个连续变量)之间都进行了Spearman相关性分析。用若干变量进行接受者操作特征(ROC)分析以确定与TMS-EEG变量的预测关联。
结果
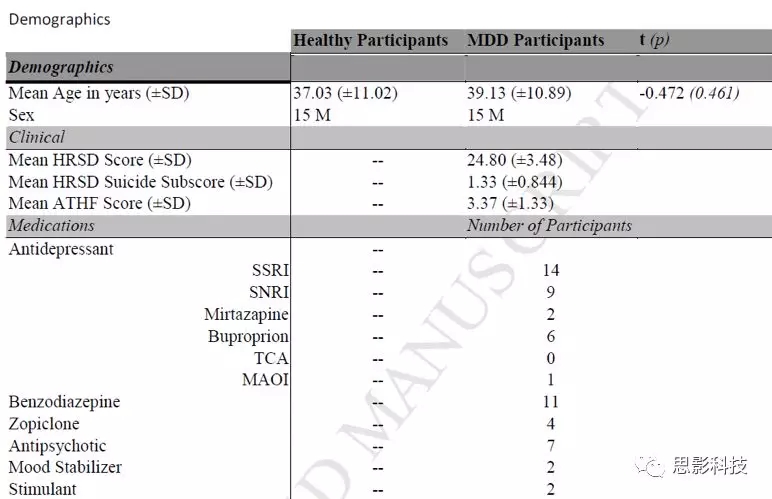
表1中列出了人口学信息。在RMT上,两组之间无显著差异。
表1. 人口学信息
GMFA成分分析
N45波幅
MDD组的平均N45幅度显著大于健康组(图3a)。由于N45振幅的非正太分布,进行对数转换,结果相同。在患有MDD的参与者中,N45振幅与年龄,性别,ATHF评分,抑郁的事件发生次数、HRSD-17评分或HRSD-17自杀子评分之间没有相关性。在N45和疾病状态(作为二分变量:0 =健康,1 = MDD)之间进行ROC分析。 N45振幅正向预测抑郁症状态,敏感性为80%,特异性为73.3%,准确性为76.6%(AUC = 0.829,p <0.001)(图4)。
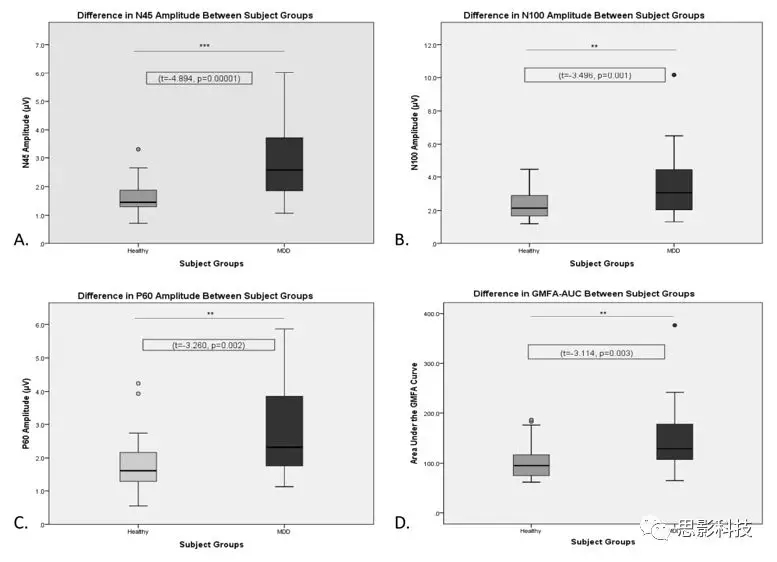
图3、健康被试和MDD病人之间的TMS-EEG标志物的差异,抑制成分包括N45,N100,兴奋性成分有P60和GMFA-AUC。
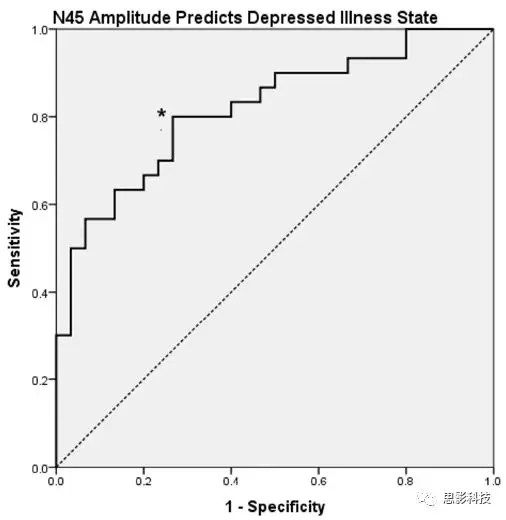
图4、ROC分析:N45幅度预测抑郁症状态,敏感性为80%,73.3%的特异性和76.6%的准确性。
N100波幅
MDD组N100平均振幅也显著大于健康组(图3b)。由于2组的N100振幅分布非正态,因此进行对数转换,结果相同。在MDD中,N100振幅与年龄,性别,ATHF评分,抑郁的事件发生次数或HRSD-17自杀分数之间无相关性。MDD的N100幅度和总体HRSD-17评分之间存在正相关关系。然而,N100振幅和HRSD-17评分变量的变化的ROC分析不显著,N100振幅和疾病状态之间的ROC分析也不显著。
苯二氮卓类药物对MDD的N45和N100的影响
由于苯二氮卓类药物对皮质抑制的影响,我们比较了在研究招募时11个使用苯二氮卓类药物的MDD与其余19人。苯并二氮卓与非苯二氮卓类药物之间的N45或N100无显著差异。
P60振幅
MDD组P60成分的平均幅度显著大于健康组(图3c)。由于健康组或抑郁组的P60振幅分布非正态,因此进行对数转换,结果相同。在MDD中,P60幅度与年龄,性别,ATHF评分,抑郁的终生发作次数,HRSD-17评分或HRSD-17自杀子评分之间没有相关性。因为没有在任何临床变量和P60之间有关,未进行ROC分析。
曲线下面积 (GMFA-AUC)
MDD组的GMFA-AUC显著大于健康组(图3d)。由于GMFA-AUC的分布对于健康组或抑郁组都非正太,因此进行了对数转换,结果相同。在MDD中,GMFA-AUC幅度与年龄,性别,ATHF评分,抑郁症终身发作次数或HRSD-17评分之间无关。在MDD中,GMFA-AUC与HRSD-17自杀评分之间存在负相关。在GMFA-AUC和MDD中是否存在自杀意念之间进行ROC分析并不显著,GMFA-AUC与疾病状态之间也没有显著性。在健康组中,在抑制性N45振幅和兴奋性GMFA-AUC之间显示出正相关,MDD组中不存在。进行Fisher's z检验证明这两个相关性有显著差异,表示与疾病状态相关的抑制/兴奋之间的潜在不平衡(图4)。
由于MDD组的参与者正在服用几种不同类型的药物,我们将14名服用SSRIs的患者与16名未服用SSRIs的患者进行了比较。9名患者服用SNRIs,21个没有服用。9名患者服用抗精神病药物或情绪稳定剂治疗,21名没有。服用药物的患者与未进行任何这些分析的患者之间的N45,P60,N100或GMFA-AUC无显著差异。N45,N100,P60幅度或GMFA-AUC与健康组的年龄或性别都无相关性。
总结
我们的结果表明,与健康者相比,MDD中TMS-EEG抑制和兴奋测量中DLPFC异常的证据(图1-2)。具体而言,MDD组中与抑制相关的成分(即N45,N100)较大(图3a-b)。此外,ROC分析显示N45幅度预测疾病组敏感性为80%,特异性为73.3%,准确性为76.6%(图4)。DLPFC中的皮质兴奋的GMFA-AUC在MDD组中也显著更大,P60也是如此(图3C-d)。最后,我们发现MDD组的兴奋/抑制失衡,因为在MDD中没有观察到健康组中的抑制和兴奋的紧密耦合(图5)。
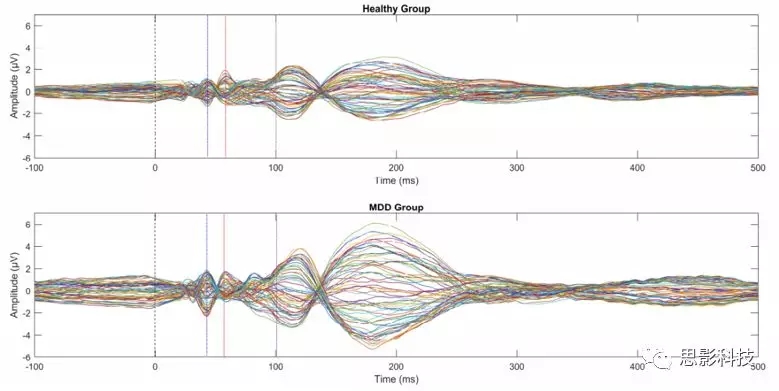
图1虚线表示TMS脉冲的时间为0,蓝线表示N45,红线表示P60,紫线表示N100
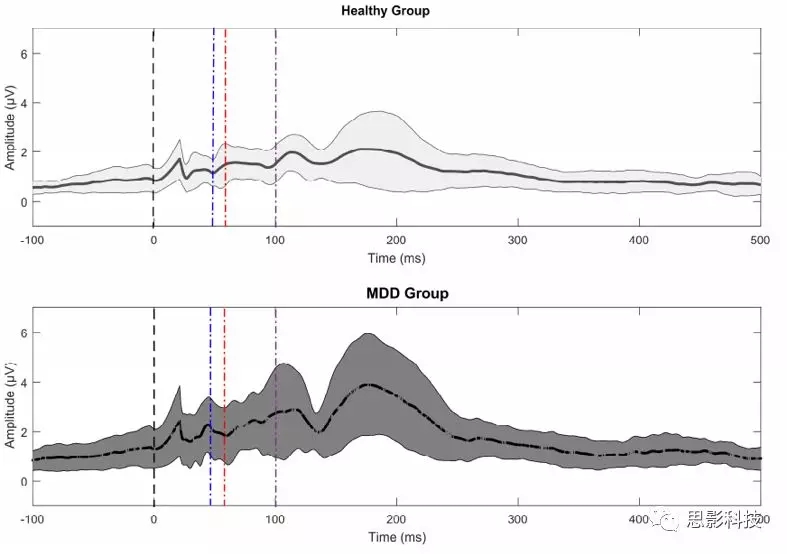
图2 GMFA图,虚线表示TMS脉冲的时间为0,蓝线表示N45,红线表示P60,紫线表示N100
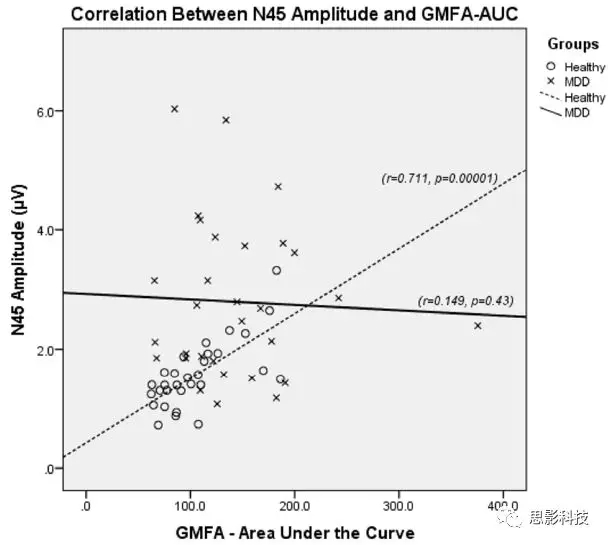
图5、在健康组中存在皮层抑制(N45幅度)与兴奋(GMFA-AUC)的相关性,但在MDD患者中没有。
总之,本结果显示,TMS-EEG测量中的异常与抑制和兴奋相关。最重要的是,我们发现N45振幅显示出作为DLPFC的神经生理学生物标志物识别抑郁状态的潜在前景。虽然需要进一步的研究,但这有望揭示基于DLPFC生理学的MDD的潜在生物学标记。
参考文献:Voineskos D, Blumberger D M, Zomorrodi R, et al.Altered Transcranial Magnetic Stimulation-Electroencephalographic Markers ofInhibition and Excitation in the Dorsolateral Prefrontal Cortex in Major Depressive Disorder[J]. Biological Psychiatry, 2018.

微信扫码关注我们
思影科技专注于脑影像
获取WORD版本:关注“思影科技”公众号,回复“原文”或“培训”,获取下载链接,同时欢迎浏览我们的其他课程通知及数据处理业务介绍。(直接点击下文文字即可浏览):
更新通知:第一届脑磁图(MEG)数据处理学习班
第十届脑电数据处理基础班
第四届脑电信号数据处理提高班
第一届眼动数据处理班
第四届近红外脑功能数据处理班
第四届磁共振脑影像结构班
第六届磁共振弥散张量成像数据处理班
第十二届功能磁共振数据处理基础班
第二届脑功能磁共振提高班暨任务态fMRI专题班
第七届磁共振脑网络数据处理班
第一届脑影像机器学习班
第三届磁共振ASL(动脉自旋标记)数据处理班
第三届动物磁共振脑影像数据处理班
思影数据处理业务一:功能磁共振(fMRI)数据处理
思影数据处理业务二:结构磁共振成像(sMRI)
思影数据处理业务三:ASL数据处理
思影数据处理业务四:EEG/ERP数据处理
招聘公告:脑影像数据处理工程师